
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;丫与M形成的气态化合物在标准状况下的密度为0.76g·L-1; W的质子数是X、Y、Z、M四种元素质子数之和的![]() ,下列说法正确的是
,下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. YZ2溶于水形成的溶液具有较强的氧化性
C. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
D. 1 molWM溶于足量水中完全反应共转移2mol电子
【答案】B
【解析】Y与M形成的气态化合物在标准状况下的密度为0.76g/L ,则该气体的相对分子质量为0.76×22.4=17,则该气体为NH3。结合X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子,可推出X是C,Y是N,Z是O,M是H。W的质子数是X、Y、Z、M四种元素质子数之和的1/2。则W是Na。A、同一周期的元素,原子序数越小,原子半径越大;不同周期的元素,原子的电子层数越多,原子半径越大。所以这几种元素的原子半径大小关系为原子半径:Na>C>N>O>H,A错误;B、二氧化氮溶于水生成NO和硝酸,硝酸具有强氧化性,B正确;C、由X、Y、Z、M四种元素形成的化合物CO(NH2)2中只有共价键,没有离子键,C错误;D、NaH与水反应的方程式为NaH+H2O=NaOH+H2↑,因此1molWM溶于足量水中完全反应共转移1mol电子,D错误;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢元素有三种核素:1H、2H、3H,氯元素有两种核素:35Cl、37Cl;最多可以组成的氯化氢分子的种类有
A. 5种 B. 6种 C. 7种 D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是
①己知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为△H=-241.8kJ/mol
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) ![]() Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④己知:![]()
上表数据可以计算出![]() 的焓变
的焓变
⑤ 根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等
A. ①②③ B. ④⑤ C. ④ D. 无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL mol·L-1H2A溶液中滴加等浓度的NaOH溶液,混合后溶液的pH与所加NaOH溶液的体积关系如图所示、下列叙述正确的是

A. NaHA的电离方程式为NaHA![]() Na++HA-
Na++HA-
B. B点:c(H2A)+c(H+)=c(OH-)+c(A2-)
C. C点:c(Na+)= c(A2-)+c(HA -)
D. D点:c(Na+)>c(A2-)>c( HA -)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于35℃的0.1mol/L NaOH溶液,以下表述错误的是( )
A.Kw>1×10﹣14
B.水电离的c(H+)>1×10﹣13 mol/L
C.pH>13
D.c(OH﹣)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下: N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
N≡N | H-H | N-H | |
键能数据( kJ/mol) | 946 | 436 | X |
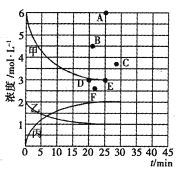
若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
(1)0-25min内,反应的平均速率v(H2)为_________;表中X=_________________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s) +H2O(g)![]() CO(g) +H2(g) △H1
CO(g) +H2(g) △H1
②CO(g) +H2O(g)![]() CO2(g) +H2(g) △H2
CO2(g) +H2(g) △H2
若已知CO和H2的燃烧热分别为283 kJ·mol-l和285.8kJ·mol-l;H2O( g) =H2O(1) △H =-44kJ·mol-l 则△H2=_______________。
(5)氨气是生产硝酸的重要原料,其过程如下:
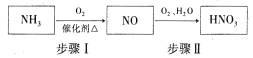
写出步骤I的化学方程式:_________________。
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:
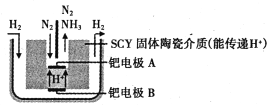
由图可知,钯电极B是电解池的________(填“阴极”或“阳极”);钯电极A上的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是原子序数递增的五种短周期主族元素,周期数之和为11,其中Y元素最高化合价与最低化合价代数和为2, Z和R可形成R2Z和R2Z2型化合物,R是五种元素中原子半径最大的,Z和W是同族元素,下列说法错误的是
A. 简单离子半径人小顺序为:W>Z>R
B. X2Z2的电子式为:![]()
C. X2Z的沸点比X2W的沸点高
D. Y元素最高价氧化物的水化物浓溶液可以用铝制容器盛装
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com