
【题目】实验室需要配制100mL 0.1molL﹣1 CuSO4溶液.
(1)本实验用到的基本实验仪器除托盘天平、胶头滴管、玻璃棒、100mL容量瓶外,还必须使用一种玻璃仪器是 .
(2)下列有关实验说法正确的是 . a.需称量CuSO45H2O晶体2.5g
b.将固体溶解、冷却后,依照如图转移至容量瓶
c.需用蒸馏水洗涤烧杯和玻璃棒2﹣3次,洗涤液均转入容量瓶
d.定容摇匀后,发现液面低于刻度线,继续向容量瓶中加水至凹液面与刻度相切即可
(3)若实验遇到下列情况,分析对所配制溶液的浓度的影响(选填“偏高”、“偏低”、“无影响”) ①容量瓶内壁附有水珠而未干燥 ,
②在定容时,俯视刻度线 .
【答案】
(1)烧杯
(2)ac
(3)无影响;偏高
【解析】解:(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,所以还缺少的仪器:烧杯;
所以答案是:烧杯;(2)a.配制100mL 0.1molL﹣1 CuSO4溶液,需要五水硫酸铜的质量为:0.1L×0.1mol/L×250g/mol=2.5g,故a正确;
b.移液时应用玻璃棒引流,图中为用玻璃棒引流,故b错误;
c.需用蒸馏水洗涤烧杯和玻璃棒2﹣3次,洗涤液均转入容量瓶,否则溶质的物质的量偏小,溶液浓度偏低,故c正确;
d.定容摇匀后,发现液面低于刻度线,继续向容量瓶中加水至凹液面与刻度相切即可,导致溶液体积偏大,依据C= ![]() 进行可知,溶液浓度偏低,故d错误;
进行可知,溶液浓度偏低,故d错误;
故选:ac;(3)①容量瓶内壁附有水珠而未干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响;
所以答案是:无影响;
②在定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
所以答案是:偏高.
【考点精析】掌握配制一定物质的量浓度的溶液是解答本题的根本,需要知道配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】下列关于碳酸钠和碳酸氢钠的叙述,正确的是( )
A.常温时,在水中的溶解性:碳酸钠>碳酸氢钠
B.热稳定性:碳酸钠<碳酸氢钠
C.质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠
D.物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于铝和烧碱溶液的反应,下列说法不正确的是( )
A. 铝是还原剂 B. H2O是氧化剂 C. NaOH和H2O是氧化剂 D. 偏铝酸钠是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A. 液溴和乙醇分别受热变为气体
B. 干冰和氯化铵分别受热变为气体
C. 硅和白磷分别受热熔化
D. 氯化氢和蔗糖分别溶解于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量都为amol的金属钠和铝一同放入mg足量的水中,所得溶液的密度为ρg/cm3 , 则此溶液的物质的量浓度为( )
A.![]()
B.![]() mol/L
mol/L
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl5的热分解反应如下:PCl5(g)PCl3(g)+Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5 , 达到平衡后,测得容器内PCl3的浓度为0.150mol/L.计算该温度下的平衡常数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( ) 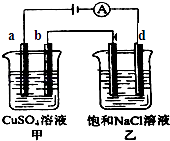
A.甲烧杯中a极上最多可析出铜0.64g
B.甲烧杯中b极上电极反应式4OH﹣﹣4e﹣═2H2O+O2↑
C.乙烧杯中滴入酚酞试液,d极附近先变红
D.烧杯中c极上电极反应式为4H++4e﹣═2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.MnO2 与浓盐酸反应制Cl2:MnO2+4HCl ![]() Mn2++2Cl﹣+Cl2↑+2H2O
Mn2++2Cl﹣+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH﹣+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com