
【题目】PCl5的热分解反应如下:PCl5(g)PCl3(g)+Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5 , 达到平衡后,测得容器内PCl3的浓度为0.150mol/L.计算该温度下的平衡常数.
【答案】
(1)解:化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故可逆反应PCl5(g)PCl3(g)+Cl2(g)的平衡常数k= ![]() ;
;
答:该反应的平衡常数表达式为 ![]() ;
;
(2)解:PCl5的起始浓度为 ![]() =0.2mol/L,达到平衡后,测得容器内PCl3的浓度为0.150mol/L,则:
=0.2mol/L,达到平衡后,测得容器内PCl3的浓度为0.150mol/L,则:
PCl5(g)PCl3(g)+Cl2(g)
开始(mol/L): 0.2 0 0
变化(mol/L): 0.15 0.15 0.15
平衡(mol/L): 0.05 0.15 0.15
所以平衡常数k= ![]() =
= ![]() =0.45;
=0.45;
答:该温度下该反应的平衡常数为0.45.
【解析】(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;(2)根据三段式计算平衡时各组分的浓度,代入平衡常数表达式计算.
【考点精析】本题主要考查了化学平衡常数的含义的相关知识点,需要掌握指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂.
A.①③
B.②④
C.②⑤
D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制100mL 0.1molL﹣1 CuSO4溶液.
(1)本实验用到的基本实验仪器除托盘天平、胶头滴管、玻璃棒、100mL容量瓶外,还必须使用一种玻璃仪器是 .
(2)下列有关实验说法正确的是 . a.需称量CuSO45H2O晶体2.5g
b.将固体溶解、冷却后,依照如图转移至容量瓶
c.需用蒸馏水洗涤烧杯和玻璃棒2﹣3次,洗涤液均转入容量瓶
d.定容摇匀后,发现液面低于刻度线,继续向容量瓶中加水至凹液面与刻度相切即可
(3)若实验遇到下列情况,分析对所配制溶液的浓度的影响(选填“偏高”、“偏低”、“无影响”) ①容量瓶内壁附有水珠而未干燥 ,
②在定容时,俯视刻度线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)Cu元素基态原子的电子排布式为 .
(2)元素N,O,S的第一电离能由大到小排列的顺序为 .
(3)S,Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为 .
(4)Cu元素与H元素可形成一种红色晶体,其结构如图1,则该化合物的化学式为 .
(5)MgH2是金属氢化物储氢材料,其晶胞结构如图2所示,已知该晶体的密度agcm﹣3 , 则晶胞的体积为cm3[用a、NA表示阿伏加德罗常数]. 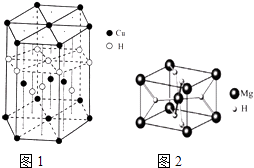
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
A.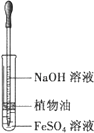 观察Fe(OH)2的生成
观察Fe(OH)2的生成
B.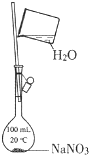 配制一定物质的量浓度的NaNO3溶液
配制一定物质的量浓度的NaNO3溶液
C. 实验室制取氨
实验室制取氨
D.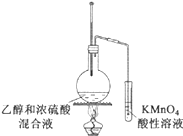 验证乙烯的生成
验证乙烯的生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com