
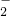
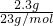 =0.1mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.1mol,AlCl3的物质的量为0.1L×0.1mol?L-1=0.01mol,n(Al3+):n(OH-)=0.01mol:0.1mol=1:10,所以Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,
=0.1mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.1mol,AlCl3的物质的量为0.1L×0.1mol?L-1=0.01mol,n(Al3+):n(OH-)=0.01mol:0.1mol=1:10,所以Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,

科目:高中化学 来源: 题型:解答题
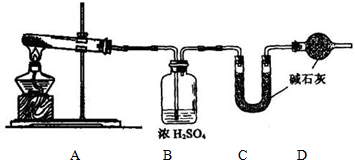 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 实验事实 | 结论 | |
| A | NH3的水溶液可以导电 | NH3是电解质 |
| B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色 | BaCl2溶液有酸性 |
| C | Na2SiO3溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>H2SiO3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列四组混合气体体积比为
①NO2:O2=2:1 ②NO:O2=2:1 ③NH3:O2=2:1 ④NO2:NO:O2=1:1:1,
将分别盛满上述各种气体的容积相等的四支试管倒置于盛有水的水槽中,最后试管内液面由低到高顺序正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com