
【题目】下列各组混合物中,用分液漏斗不能分离的是
A. 苯和水 B. 乙酸乙酯和水 C. 溴乙烷和水 D. 乙酸和水
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为:
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol·L-1·s-1
B. 其他条件不变,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
C. T1温度下的平衡常数为K1=125,1000s时转化率为50%
D. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(C1O3)2·6H2O 的流程如下:
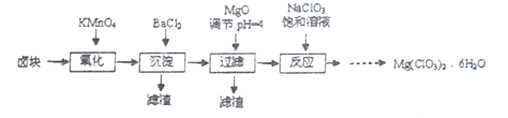
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
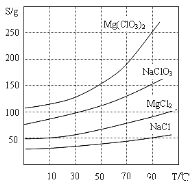
(1)过滤所需要的主要玻璃仪器有_________。
(2)加MgO后过滤所得滤渣的主要成分的化学式为_________。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①________;______;洗涤;②将滤液冷却结晶;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式__________;
② 产品中Mg(ClO3)2·6H2O的质量分数为_______。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境、材料信息关系密切,下列说法不正确的是
A. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
B. 有一种新发现的固态碳,这种碳的结构称为“纳米泡沫”,外形类似海绵,密度小且有磁性。这种碳与金刚石的关系是互为同素异形体
C. 聚乙炔用I2或Na 等掺杂处理后可形成一种导电塑料,该导电塑料有固定的熔、沸点
D. 工业上电解熔融的氯化钠、氯化镁、氧化铝来制取钠、镁、铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四个试管中都装有5mL0.1mol·L-1Na2S2O3溶液,分别在不同温度下加入0.1mol·L-1硫酸和一定量水,最先出现浑浊的是( )
A.20℃,10mL硫酸B.20℃,5mL硫酸,5mL水
C.30℃,5mL硫酸,2mL水D.30℃,4mL硫酸,3mL水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
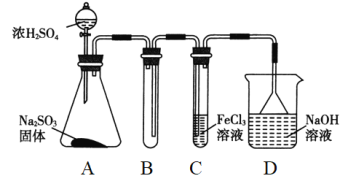
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)不溶于水,但在一定条件下水解生成两种酸,其中一种是甲酸(HCOOH)。在19世纪氯仿广泛用于麻醉,可由“乙醛漂白粉法”制得。在光照条件下,氯仿易被空气氧化生成剧毒光气(COCl2)和一种化合物。因此氯仿需要小口钢罐贮存运输,使用前要检验其是否变质。
(1)CHCl3的电子式为__________,HCOOH中C的杂化方式为__________;
(2)漂白粉中三种元素的简单离子的半径的大小顺序为__________(用离子符号表示);
(3)氯仿不溶于水而甲酸易溶于水的原因是__________;
(4)Fe2+的外围电子排布图为__________;
(5)纯铁的一种同素异形体的晶胞为面心立方晶胞,该晶体中原子的配位数为__________,若铁原子的半径为a cm,则该晶体的密度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡,烧杯内剩余固体27g,求反应中产生气体的质量。___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com