
【题目】化学与生活、环境、材料信息关系密切,下列说法不正确的是
A. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
B. 有一种新发现的固态碳,这种碳的结构称为“纳米泡沫”,外形类似海绵,密度小且有磁性。这种碳与金刚石的关系是互为同素异形体
C. 聚乙炔用I2或Na 等掺杂处理后可形成一种导电塑料,该导电塑料有固定的熔、沸点
D. 工业上电解熔融的氯化钠、氯化镁、氧化铝来制取钠、镁、铝
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】能通过置换反应得到金属铁的是
A. Na与FeSO4溶液常温混合 B. CO通过灼热的Fe2O3
C. H2通入FeSO4溶液 D. Al和Fe3O4混合加热至高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的有机化工原料。
(1)已知:
①C2H4(g)+H2O(g)→C2H5OH(g) ΔH1=-45.5 kJ/mol
②2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol
③C2H5OH(g)→CH3OCH3(g) ΔH3=+50.7 kJ/mol
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:__________。
(2)合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
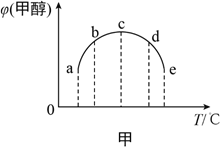
①温度升高甲醇的体积分数增大的原因是__________.
②根据图像判断ΔH__________(填“>”、“<”或“=”)0。
(3)为了研究甲醇转化为二甲醚的反应条件,某研究与小组在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | T1 | 0.20 | 0.080 | 0.080 |
Ⅱ | T1 | 0.40 | A | a |
Ⅲ | T2 | 0.20 | 0.090 | 0.090 |
①T1温度下该反应的平衡常数K=__________;反应温度T1__________T2(填“大于”或“小于”。)
②容器Ⅱ中a=__________。
③下列说法能说明反应达到平衡状态的是__________(填字母)。
A.容器中气体压强不再变化
B.用CH3OH和CH3OCH3表示的反应速率之比为2:1
C.混合气体的密度不变
D.容器内CH3OH和CH3OCH3的浓度之比为2:1
E.混合气体中c(CH3OCH3)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。

(1)B是____________,W是__________。(填化学式)
(2)用单线桥法标出反应①电子转移的方向和数目:_________________。
(3)写出G与Cu在加热条件下能反应生成E和F的物质的量之比为1∶1的化学方程式:________________________________________________________________________。
(4)若W是酸式盐,_________g W加热分解的产物通过足量的Na2O2,固体Na2O2增重3g,则转移的电子总数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
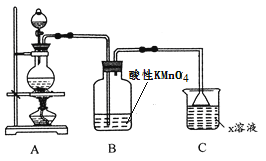
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为____________。C装置的作用_____________。
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是__________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
验证该气体的实验方案如下:
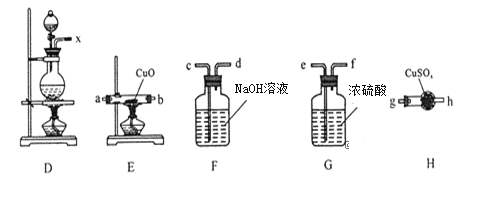
①装置连接顺序:X→ ___→___→___→___→a→b→_____;
②能证明上述假设成立的实验现象是_____________。
③某学习小组经过讨论认为该实验方案还不够严谨,你认为是否合理,若合理,则不作答,若不合理,请指出不严谨之处__________________________。
④若把D中的反应液倾倒入盛水的烧杯中,为氧化其中的某离子,可供选用的试剂: a、Cl2;b、Br2;c、稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填字母),反应的离子反应方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)5 mol的CO2与8 mol的SO2的分子数之比是________;原子数之比是________;质量比是________。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:________KClO3+________HCl(浓)===________KCl+________ClO2↑+________Cl2↑+________H2O
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的________(填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是(填写号码)________。
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________倍(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列递变规律不正确的是
A.Na、Mg、Al原子的失电子能力逐渐减弱
B.Si、P、S元素的最高正化合价依次降低
C.C、N、O的原子半径依次减小
D.Cl、Br、I的气态氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
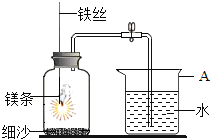
【题目】某学习小组用右图做镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
(1)瓶底铺细沙的原因是__________________________________________;
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的________%。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成推测原因可能是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com