
【题目】为了检验某溶液中是否含有SO42-,试剂除BaCl2溶液外,还需要
A. H2SO4 B. HCl C. HNO3 D. NaOH
科目:高中化学 来源: 题型:
【题目】(1)有①168 O 、 17 8O 、 188O ;②H2、D2、T2;③石墨、金刚石;④11H 、21H、 31H;四组微粒或物质。互为同位素的是_____(填编号)。
(2)下列物质中:①N2;②MgCl2;③NH4Cl;④CH4;⑤CO2;⑥Ne;⑦H2S;⑧KOH;⑨Na2O2; ⑩K2O;只存在共价键的是_____;属于离子化合物,但含有共价键的 是_____。
(3) 用电子式表示下列物质:
MgCl2 _____; N2 _____;
NH4+_____; Na2O2 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,容积为5L的某密闭容器中将1mol A和2mol B发生如下反应:A(s)+2B(g) ![]() C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。下列叙述不正确的是( )
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。下列叙述不正确的是( )
A. 在5min内该反应用C的浓度变化表示的反应速率为0.02mol/(L·min)
B. 5min时,容器内D的浓度为0.2mol/L
C. 5min时容器内气体总的物质的量为3mol
D. 当容器内压强保持恒定时,该可逆反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作合理的是
A.用10mL量筒量取7.50mL稀盐酸
B.用25mL碱式滴定管量取14.80mLNaOH溶液
C.用广泛pH试纸测得某碱溶液的pH为12.7
D.用托盘天平称取25.20gNaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g) +2B(s)![]() y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
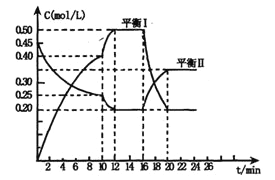
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=________;
(2)根据图示可确定x:y=_______________;
(3)0~l0min容器内压强_______________(填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是____________;第16min引起曲线变化的反应条件可能是____________;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C,在周期表中所处的位置如图所示。A、B、C三种元素原子质子数之和为32。D元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是

A. 元素D形成的气态氢化物一定是正四面体型分子
B. B、C两种元素可形成BC6型化合物,该化合物在空气中能燃烧
C. 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最大
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且反应类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com