
溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式IBr+H2O===HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是 ( )

A.C和O2 B.CO2和NaOH溶液
C.Cl2和Fe D.AlCl3溶液和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体通入下列溶液中,能生成白色沉淀且不溶解的是( )
①Ba(OH)2溶液 ②Ba(NO3)2溶液 ③BaCl2溶液
④Ba(ClO)2溶液
A.①② B.①③
C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在新制的氯水中加入少量的碳酸钠粉末,下列说法正确的是 ( )
A.pH增大,HClO浓度增大
B.pH减小,Cl-浓度增大
C.pH增大,Cl-浓度减小
D.pH减小,HClO浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪些事实或实验能说明氧化性:Cl2>Br2>I2______________________________。
①氯水分别滴入KBr、NaI溶液中颜色加深,而溴水滴入NaCl溶液中无明显变化,滴入KI淀粉溶液中,溶液变蓝
②H2和Cl2的混合气体光照爆炸,H2和Br2的混合气体加热才能反应,而H2和I2反应更困难
③Fe分别与Cl2、Br2、I2反应生成Fe的化合物的化合价高低
④HCl、HBr、HI的热稳定性越来越差
⑤Cl2、Br2、I2在水中的溶解度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在 上面。
上面。
已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
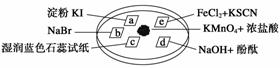
对实验现象的“解释或结论”正确的是 ( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
五颜六色的颜色变化增添了化学的魅力,下列有关反应的颜色叙述正确的是 ( )
①新制氯水久置后→浅黄绿色消失 ②淀粉溶液遇单质碘→蓝色 ③溴化银见光分解→银白色 ④Na2CO3溶液中滴加酚酞→红色 ⑤鸡蛋白溶液遇浓硝酸→黄色 ⑥碘化银的悬浊液中加入硫化钠晶体,振荡后变黑
A.①②③④⑤ B.②③④⑤⑥
C.①②④⑤⑥ D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
 ①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:

①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
查看答案和解析>>
科目:高中化学 来源: 题型:
联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是________(填字母序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢: 2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O  CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为______________________。
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:
 CO(g)+2H2(g)
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com