
 Fe(OH)3+5OH-]
Fe(OH)3+5OH-]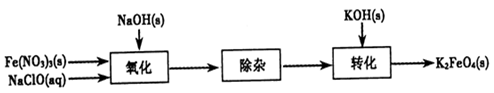
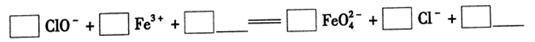
 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示: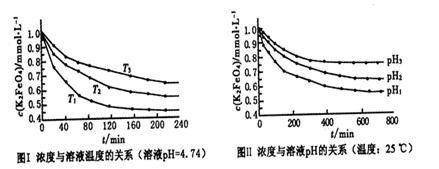
 Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。
Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源:不详 题型:单选题
| A.0.34 mol | B.0.38 mol |
| C.0.28 mol | D.0.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | X | Y | Z |
| W | | | |

 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 mol | B.2.5 mol | C.3 mol | D.4 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
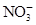 、Fe3+、
、Fe3+、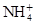 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )| A.氧化剂与还原剂的物质的量之比为8∶1 |
B.还原产物为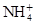 |
C.若有1 mol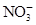 参加还原反应,转移8 mol e- 参加还原反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.6.72 L | B.11.2 L | C.22.4 L | D.4.48 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com