
| A.①② | B.②③ | C.③④ | D.①④ |
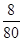 :
: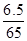 =1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B.
=1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B. 

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe(OH)3+5OH-]
Fe(OH)3+5OH-]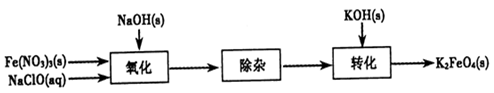
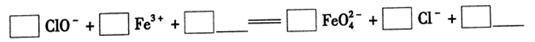
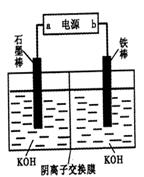
 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示: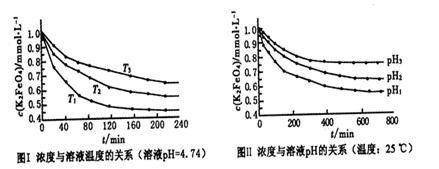
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.15 mol/L | B.0.225 mol/L |
| C.0.30 mol/L | D.0.45 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。| A.方框中的物质应为CuS |
| B.该反应的部分产物可用于硫酸工业 |
| C.反应中SO2既是氧化产物又是还原产物 |
| D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe(NO3)x中的x为2 |
| B.磁性氧化铁中的铁元素全部被氧化 |
| C.稀HNO3在反应中只作氧化剂 |
| D.反应中每生成0.4 mol还原产物,就有1.2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成1 mol N2,电子转移总数为3NA | B.生成1 mol N2,电子转移总数为5NA |
| C.溶解1 mol Zn,电子转移总数为2NA | D.溶解1 mol Zn,电子转移总数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com