
����Ŀ��[Cu��NH3��4]SO4H2O��һ��ɱ�����
��1��CuԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ �� ����Ԫ��ԭ�ӵ���Χ�����Ų��������ɽ����ڱ��ֳ������������Cu��������
��2��Ԫ��N��O��S�ĵ�һ�������ɴ�С���е�˳��Ϊ ��
��3��HԪ�ؿ���OԪ���γ�H2O��H2O2 �� H2O2������H2O������Ҫԭ��Ϊ ��
��4��HԪ����NԪ�ؿ���ɻ�����N2H4 �� ����Nԭ�ӵĹ���ӻ���ʽΪ ��
��5��SO42���Ŀռ乹���� �� ��SO42����Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ ��
��6��CuԪ����HԪ�ؿ��γ�һ�ֺ�ɫ���壬��ṹ��ͼ����û�����Ļ�ѧʽΪ �� 
���𰸡�
��1��[Ar]3d104s1��ds
��2��N��O��S
��3��H2O��H2O2֮���γ����
��4��sp3
��5���������壻CCl4��SiCl4��SO2Cl2
��6��CuH
���������⣺��1��Cu��29��Ԫ�أ���3d�ܼ�����10�����ӡ�4s�ܼ�����1�����ӣ����ݹ���ԭ����дCuԭ�Ӻ�������Ų�ʽ[Ar]3d104s1��Cu����ds�������Դ��ǣ�[Ar]3d104s1��ds����2��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ��ҵ�IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ�������������С������������Ԫ�ص�һ�����ܴ�С˳����N��O��S�����Դ��ǣ�N��O��S����3��H2O��H2O2֮�����γ��������˫��ˮ������ˮ�����Դ��ǣ�H2O��H2O2֮���γ��������4���·�����ÿ��Nԭ���γ�3����ѧ����ÿ��Nԭ�Ӻ���1���µ��Ӷԣ����ݼ۲���ӶԻ�������ȷ��Nԭ���ӻ���ʽΪsp3 �� ���Դ��ǣ�sp3����5����������Ӽ۲���ӶԸ���=4+ ![]() =4�����ݼ۲���ӶԻ�������ȷ����������ӿռ乹��Ϊ�������壻ԭ�Ӹ�����ͬ���۵�������ȵ�����Ϊ�ȵ����壬����������ӻ�Ϊ�ȵ��������CCl4��SiCl4��SO2Cl2�����Դ��ǣ��������壻CCl4��SiCl4��SO2Cl2����6���þ�����Cuԭ�Ӹ���=3+12��
=4�����ݼ۲���ӶԻ�������ȷ����������ӿռ乹��Ϊ�������壻ԭ�Ӹ�����ͬ���۵�������ȵ�����Ϊ�ȵ����壬����������ӻ�Ϊ�ȵ��������CCl4��SiCl4��SO2Cl2�����Դ��ǣ��������壻CCl4��SiCl4��SO2Cl2����6���þ�����Cuԭ�Ӹ���=3+12�� ![]() +2��
+2�� ![]() =6��Hԭ�Ӹ���=4+6��
=6��Hԭ�Ӹ���=4+6�� ![]() =6�������仯ѧʽΪCuH�����Դ��ǣ�CuH��
=6�������仯ѧʽΪCuH�����Դ��ǣ�CuH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�������������
��1��þԭ�ӵĽṹʾ��ͼ_________________��
��2�������Ƶĵ���ʽ__________________��
��3��SiԪ��Ԫ�����ڱ��е�λ����__________________________��
��4����ԭ������1~20�ŵ�Ԫ����,����������Ӧ��ˮ�����м�����ǿ����_____(�û�ѧʽ��ʾ)
��5��Ԫ�����ڱ�������������Ӧˮ����������ǿ����________________(�û�ѧʽ��ʾ)
��6��������Ԫ���У�������Ϊ����������2����Ԫ����_________________��(��Ԫ�ط��ű�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������  ��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£�
��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£� 
![]()
�����õ����й��������£�
���� | �ܶȣ�20�棩 | �۵� | �е� | �ܽ��� | ��Է������� |
������ | 0.962g/cm3 | 25.9�� | 160.8�� | 20��ʱˮ���ܽ��3.6g���ɻ������Ҵ����� | 100 |
�Ҷ��� | 1.36g/cm3 | 152�� | 337.5�� | ��ˮ�е��ܽ�ȣ�15��ʱ��1.44g��25��ʱ2.3g���������Ҵ��������ڱ� | 146 |
ʵ�鲽�����£�
I����������ƿ�м���16mL 50%�����ᣨ�ܶ�Ϊ1.31g/cm3�����ټ���1��2����ʯ����Һ©����ʢ����5.4mL��������
��ˮԡ����������ƿ��50�����ң���ȥˮԡ�������μ�5��6�λ�������ҡ��������ƿ���۲쵽�к���ɫ����ų�ʱ�������μ�ʣ�µĻ�������ά�ַ�Ӧ�¶���60�桫65��֮�䣮
��������ȫ��������������80�桫90��ˮԡ����Լ10min��ע������¶ȣ���ֱ������ɫ��������Ϊֹ��
IV�����Ƚ���ӦҺ�����ձ��У������ˮԡ����ȴ�������������ˡ�ϴ�ӵôֲ�Ʒ��V���ֲ�Ʒ���ᴿ�����Ϊ5.7g��
��ش��������⣺
��1������b������Ϊ ��
��2����������ƿ�еμӻ�����ʱ��Ҫ���ƺû������ĵ������ʣ���ֹ��Ӧ���ھ��ҵ����¶�Ѹ����������������ɽ����صĺ�������о�һ�����ܲ����ĺ���� ��
��3����֪��NaOH��Һ����β��ʱ��������ط�Ӧ����ʽΪ��2NO2+2NaOH�TNaNO2+NaNO3+H2O��NO+NO2+2NaOH�T2NaNO2+H2O��������ô�����Һ����β��ʱҲ�ܷ������Ʒ�Ӧ������ط�Ӧ����ʽΪ���� ��
��4��Ϊ�˳�ȥ���ܵ����ʺͼ��ٲ�Ʒ��ʧ���ɷֱ��ñ�ˮ��ϴ�Ӿ��壮
��5���ֲ�Ʒ�������ᴿ����ʵ��������ƣ�����ʵ�����õ��ļ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��H��I�����ɶ�����Ԫ����ɵ���ѧ�������ʣ�B��D��E��GΪ���ʣ�F��һ�ֳ����Ľ��������AΪ�ȼҵ�IJ���֮һ��BԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�C��һ����ɫ��ζ��Һ�壬D��һ��������Դ���ʣ���Щ���ʵ�ת����ϵ���£���Ӧ��������ȥ����Ӧ���������ﶼ�ѱ�����ͼ�У���
��ش��������⣺
��1��A��������ѧ��������Ϊ������I�ĵ���ʽΪ ��
��2��д���ڵ����ӷ�Ӧ����ʽ ��
��3����GΪʵ�����г��������Ҵ�����Ϊ��ȩ�����ʣ���FΪ��д��ѧʽ����
��4����GΪ�������ڹ���Ԫ�أ�F��B�Ļ���ﳣ������·�Ϻ������죮д��G��C��һ�������·�Ӧ�Ļ�ѧ����ʽ ��
��5��25��Cʱ��pH��Ϊ10��A��H��ƿ��Һ�У���ˮ�������������������Ũ��֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ��(�г���������ȥ)̽��ͭ˿�����Ũ���ᷴӦ�IJ�������й�˵������ȷ���� ��������
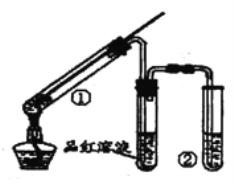
A. Ʒ����Һ����������֤SO2��Ư����
B. �Թܢ���ʢ�ŵ��Լ�������NaOH��Һ��Na2SO3��Һ
C. ֹͣ��Ӧ������������м�ˮ����Һ����ɫ
D. �÷�Ӧ��Ũ����ȱ�����ǿ�����ԣ��ֱ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵľ����У�����������ͬ����
A.O2��SiO2B.NaI��I2C.CO2��H2OD.CCl4��NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽC9H10O2���л����ṹ�к��б����ҿ����뱥��NaHCO3��Һ��Ӧ�ų������ͬ���칹���У������������칹���� ��
A.12��
B.13��
C.14��
D.15��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ�У��������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.1.0 mol/L Na2CO3��Һ��c��OH����=c��HCO ![]() ��+c��H+��+2c��H2CO3��
��+c��H+��+2c��H2CO3��
B.1.0 mol/L NH4Cl��Һ��c��NH ![]() ��=c��Cl����
��=c��Cl����
C.���������Һ�м����������ᣬ�õ������Ի����Һ��c��Na+����c��CH3COO������c��H+����c��OH����
D.1 mol/L CH3COONa��Һ��c��CH3COO����=1 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ����ɫ��ˮ����ͭ��ĩͶ�뵽150g����ˮ�У���ֽ�����˵õ�һ����������ɫ�����84g��Һ����֪���¶�����ˮ����ͭ���ܽ��Ϊ40g����˰���ˮ����ͭ�������ǣ� ��
A.60 g
B.66 g
C.90 g
D.184 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com