
【题目】已知 。分析下图变化,试回答下列问题:(E没有支链)
。分析下图变化,试回答下列问题:(E没有支链)

(1)写出下列有机物的结构简式:
A___________________C _______________________E ____________________F_________________。
(2)写出下列有关反应的化学方程式:
C →D_______________________;
D →E_______________________;
E→F_______________________。
【答案】 ![]()
![]() CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3 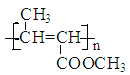
![]()
![]() CH3CH=CH-COOH+H2O CH3CH=CH-COOH+CH3OH
CH3CH=CH-COOH+H2O CH3CH=CH-COOH+CH3OH![]() CH3-CH=CHCOOCH3+H2O n CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3+H2O n CH3-CH=CHCOOCH3![]()
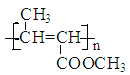
【解析】已知 。分析下图变化,试回答下列问题:(E没有支链)
。分析下图变化,试回答下列问题:(E没有支链)

(1)根据A生成B的条件结合信息和E没有支链可知,A发生信息中反应生成 B,根据A的分子式可知,A为CH3CH2CHO,A与HCN发生加成反应生成B为CH3CH2CHOHCN,B水解得C为CH3CH2CHOHCOOH,C在浓硫酸作用下加热发生消去反应得D为CH3CH=CHCOOH,D发生酯化反应生成E,E为CH3CH=CHCOOCH3,E发生加聚反应得F为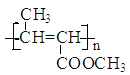 。综上所述,A为CH3CH2CHO,C为CH3CH2CHOHCOOH,E为CH3CH=CHCOOCH3,F为
。综上所述,A为CH3CH2CHO,C为CH3CH2CHOHCOOH,E为CH3CH=CHCOOCH3,F为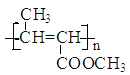 ,故答案为:CH3CH2CHO;CH3CH2CHOHCOOH;CH3CH=CHCOOCH3;
,故答案为:CH3CH2CHO;CH3CH2CHOHCOOH;CH3CH=CHCOOCH3;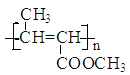 ;
;
(2)C →D的化学方程式为![]()
![]() CH3CH=CH-COOH+H2O;D →E的化学方程式为CH3CH=CH-COOH+CH3OH
CH3CH=CH-COOH+H2O;D →E的化学方程式为CH3CH=CH-COOH+CH3OH![]() CH3-CH=CHCOOCH3+H2O;E→F的化学方程式为CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3+H2O;E→F的化学方程式为CH3-CH=CHCOOCH3![]()
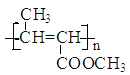 ;故答案为:
;故答案为:![]()
![]() CH3CH=CH-COOH+H2O;CH3CH=CH-COOH+CH3OH
CH3CH=CH-COOH+H2O;CH3CH=CH-COOH+CH3OH![]() CH3-CH=CHCOOCH3+H2O;n CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3+H2O;n CH3-CH=CHCOOCH3![]()
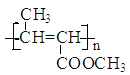 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:

(1)NH4Al(SO4)2可作净水剂,其理由是________________________________________________________ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() )__________(填“等于”、“大于”或“小于”) 0.1 mol/L (NH4)2SO4溶液中的c(
)__________(填“等于”、“大于”或“小于”) 0.1 mol/L (NH4)2SO4溶液中的c(![]() )。
)。
(3)如图1是0.1 mol/L电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是__________(填写字母),导致pH随温度变化的原因是_____________________________________________________________;
②20℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )c(
)c(![]() )3c(Al3+)=_________(填数值)。
)3c(Al3+)=_________(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是______;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I一反应成I3一,并在溶液中建立如下平衡:I2+I一 ![]() I3一。通过测平衡体系中c(12)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3一。通过测平衡体系中c(12)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c (12),采用如下方法:取V1mL平衡混合溶液,用c mol/L的Na2S203溶液进行滴定(反应为I2+2Na2S203=2Nal+Na2S406),消耗V2mL的Na2S203溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用____ 做指示剂,滴定终点的现象是____。
(2)下列对该同学设计方案的分析,正确的是______填字母)。
A.方案可行。能准确测定溶液中的c (12)
B.不可行。因为I一能与Na2S203发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知:①I-和I3一不溶于CC14;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作I使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是____(填名称)。试指出该操作中应注意的事项为____。(任写一条)
(4)下层液体中碘单质的物质的量浓度是________。
(5)实验测得上层溶液中c(I3一)=0.049 mol/L,结合上述有关数据,计算室温条件下反应I2+I一![]() I3一的平衡常数K= ___(用具体数据列出计算式即可)。
I3一的平衡常数K= ___(用具体数据列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近热播剧《外科风云》中利多卡因药物引发的医疗问题扑朔迷离,盐酸利多卡因(F)葡萄糖注射液,可用于抗心律失常。其合成路线如下:

(1)写出A的名称______________________。
(2)C的结构简式为______________________.
(3)B有多种同分异构体,符合以下条件的B的同分异构体(不包括B本身)共有_______________种,请写出其中一种的结构简式_____________________。
①苯环上共有三个取代基 ②与碳酸氢钠溶液反应可放出CO2气体
(4)对氨基苯甲酸是机体细胞生长和分裂所必需的叶酸的组成成分。现以甲苯为原料,结合题干有关信息,补充完成以下合成路线:____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107
②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2
③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低
④蒸干AlCl3溶液可得纯净的无水氯化铝
⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com