
| 1 |
| 2 |
| A、Q1=Q2=98.32 |
| B、Q1>Q2>98.32 |
| C、Q2<Q1<98.32 |
| D、Q1<Q2<98.32 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、②④⑥ |
| C、②③④⑦ | D、①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150.0mL 1.0 mol/L NaCl溶液 |
| B、75.0mL 2.0 mol/L MgCl2溶液 |
| C、150.0mL 2.0 mol/LKCl溶液 |
| D、75.0 mL 1.0 mol/L A1C13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+OH-=H2O+CO32- |
| B、NH3+H+=NH4+ |
| C、NH3?H2O?NH4++OH- |
| D、HCO3-+H2O?H2CO3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液 |
| B、溴水 |
| C、酸性高锰酸钾溶液 |
| D、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
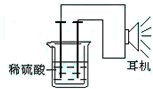 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定含有的离子种类 | |||||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com