
����Ŀ����ͼ��ʾ��ij��ѧ��ȤС�������һ��ȼ�ϵ�أ���̽���ȼҵԭ���ʹ�ͭ����ԭ����������װ����XΪ�����ӽ���Ĥ������Ҫ��ش��������:

��1��ͨ�������ĵ缫Ϊ_____���������������������������˵缫��ӦʽΪ_________��
��2�����缫Ϊ_______����������������������������װ���е�ⷴӦ�Ļ�ѧ����ʽΪ_________________��
��3��ij��ͭ�к������������Ͳ������ʣ�ͨ����⾫�ƺ�Ϊ�ӵ��Һ���Ƶ�����ͭ����(CuSO4��5H2O)����������¹������̣�
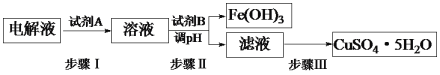
��֪�����ֽ��������ӿ�ʼ�����ͳ�����ȫ��pH��
�������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
Fe3�� | 1.9 | 3.2 |
Fe2�� | 7.6 | 9.6 |
Cu2�� | 4.7 | 6.7 |
�ٲ���I�м����Լ�A��Ŀ����_____________________________���Լ�AӦѡ��______(�����)��
a������ b���������� C�����Ը��������Һ
�ڲ���II���Լ�BΪ_________�����һ�ּ��ɣ�������pH�ķ�Χ��___________��
�۲���III�IJ����Ǽ���Ũ����___________�����ˡ�
���𰸡����� O2+4e����2H2O��4OH�� ���� 2NaCl��2H2O![]() 2NaOH��C12����H2�� ��Fe2������ΪFe3�� b CuO��Cu(OH)2��Cu2(OH)2CO3 3.2��pH<4.7 ��ȴ�ᾧ
2NaOH��C12����H2�� ��Fe2������ΪFe3�� b CuO��Cu(OH)2��Cu2(OH)2CO3 3.2��pH<4.7 ��ȴ�ᾧ
��������
��1��ȼ�ϵ����ͨ�������ĵ缫�������������ϵõ��ӷ�����ԭ��Ӧ��������ȼ��ʧ���ӷ���������Ӧ��
��2�����缫��������̼����������װ���е���Ȼ��Ʊ�����Һʱ�������������ӷŵ磻
��3�����õ�ⷨ���д�ͭ�ᴿʱ��ͭӦ����������ͭ����������֪�����Ļ��˳��ΪFe>Cu>Ag>Pt>Au������ڵ�������Ag��Pt��Au����ʧȥ���ӣ������γ������࣬˫��ˮ���������ԣ����Խ�������������Ϊ���������ӣ��Ҳ��������������ӣ�ʵ�ֹ����Һ��ķ�����õķ����ǹ��ˣ�����pHʱ�ܶȻ�С�����γɳ����������Դ˷�����
��1��ȼ�ϵ����ͨ�������������ĵ缫�������������ϵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ![]()
�ʴ�Ϊ��������![]() ��
��
��2�����缫����ԭ��ظ�����������������̼������������Ȼ��Ʊ�����Һʱ����ⷴӦ�Ļ�ѧ����ʽΪ��![]() ��
��
�ʴ�Ϊ��������![]() ��
��
��3���ٲ���I�м����Լ�A�ǹ������⣬Ŀ���ǽ�Fe2+����ΪFe3+��������������ɫ�������������������в��������ʣ���������Ⱦ
�ʴ�Ϊ����Fe2+����ΪFe3+��b��
�ڳ�ȥͭ���ӵ���Һ�е��������������ӣ�Ϊ�˲������������ӣ�����������ˮ���ԭ������ȥ�����Լ��룺CuO��Cu(OH)2��Cu2(OH)2CO3�����ݼ��ֽ��������ӿ�ʼ�����ͳ�����ȫ��pH���ݣ���Ҫ������pH��Χ��3.2��pH<4.7��
�ʴ�Ϊ��CuO��Cu(OH)2��Cu2(OH)2CO3��3.2��pH<4.7��
������ͭ��Һ�õ�����ͭ����Ĺ����ǣ�����Ũ������ȴ�ᾧ�����ˣ�
�ʴ�Ϊ����ȴ�ᾧ�����ˡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��һ�廷����(![]() )��NaOH�Ĵ���Һ���ȷ�������ˮ�ⷴӦ������ȥ��Ӧ���ס��ҡ�����λͬѧ�ֱ������������ʵ�鷽����
)��NaOH�Ĵ���Һ���ȷ�������ˮ�ⷴӦ������ȥ��Ӧ���ס��ҡ�����λͬѧ�ֱ������������ʵ�鷽����
�ף���Ӧ���Һ�е���ϡ�����к�NaOH��Ȼ���ٵ���AgNO3��Һ������dz��ɫ�����������֤����������ȥ��Ӧ��
�ң���Ӧ���Һ�е�����ˮ������Һ��ɫ�ܿ���ȥ�����֤����������ȥ��Ӧ��
������Ӧ���Һ�е�������KMnO4��Һ������Һ��ɫ��dz�����֤����������ȥ��Ӧ��
������ȷ���ǣ� ��
A. �� B. �� C. �� D. ����ʵ�鷽��������ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ����Դ�ḻ���ڷ�ˮ�����Һ�о��и��ߵ����ӵ����ʵ��ŵ㡣һ�ּ����ӵ�صĹ���ԭ����ͼ��ʾ����֪�õ�ظ�����KC24-KC16-KC8֮��仯��������K2MnFe(CN)6-KMnFe(CN)6-MnFe(CN)6֮��仯������˵������ȷ���ǣ� ��
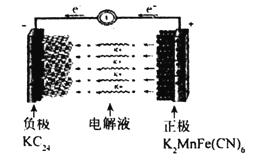
A.��ͼ��ʾΪ�����ӵ�صķŵ����
B.�ŵ�ʱ�����ɷ�����Ӧ��2KC8-e-=KC16+K+
C.���ʱ������ӦʽΪK2MnFe(CN)6-e-=KMnFe(CN)6+K+
D.�����ǰ������������ͬ������ʱÿת��0.lmole-�����������������������7.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A.��ҵ��������Ĺ�����ʹ�ù���������������߶��������ת����
B.��Ӧ2HI(g)![]() H2(g)��I2(g) ��ƽ�����С��Ӧ������������������ɫ����
H2(g)��I2(g) ��ƽ�����С��Ӧ������������������ɫ����
C.�ϳɰ�����ͨ������20 MPa��50 MPaѹǿ�������ԭ�ϵ�������
D.��HCl��Һ��������ˮϴ��AgCl�����Լ��ٳ�����ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A. 32 g S8�����ӽṹ��![]() ���еĹ��ۼ���ĿΪNA
���еĹ��ۼ���ĿΪNA
B. 2 g��H218O��2H2O��ɵ������к��е�������ΪNA
C. 8 g CuO������H2��ַ�Ӧ����Cu���÷�Ӧת�Ƶĵ�����Ϊ0.2NA
D. ��״���£�11.2 L Cl2����ˮ����Һ��Cl����ClO����HClO������֮��ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵������ȷ����
A. ��![]() ��Һ��ͨ��
��Һ��ͨ��![]() ��
��![]() ��С
��С
B. ��![]() ��
��![]() ��Һ��
��Һ��![]() ������
������![]() ��
��![]() ����
����
C. ��![]() ��HF��Һ�еμ�NaOH��Һ�����ԣ�
��HF��Һ�еμ�NaOH��Һ�����ԣ�![]() =1
=1
D. ��![]() ��
��![]() ��Һ�м�������ˮ��
��Һ�м�������ˮ��![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժһ�����³ɹ�ʵ���˼����Ч������ϩ�������ڴ����������⣬�������о����ɻ�ż����Ӧ������ϩ���䷴Ӧ���£�2CH4(g)C2H4(g)��2H2(g)����H��0
��ѧ�� | H��H | C��H | C��C | C��C |
E(kJ/mol) | a | b | c | d |
��1����֪��ػ�ѧ���ļ������ϱ��������Ʊ���ϩ��Ӧ�Ħ�H��____________ (�ú�a��b��c��d�Ĵ���ʽ��ʾ)��
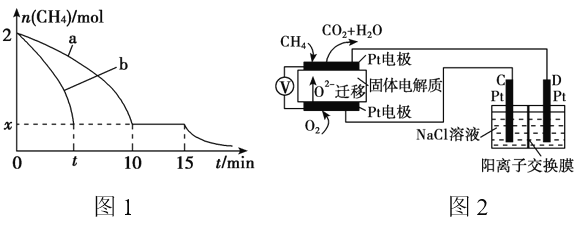
��2��T1�¶�ʱ����1 L�ĺ��ݷ�Ӧ���г���2mol CH4 ��������������Ӧ����Ӧ������ 0��15min CH4�����ʵ�����ʱ��仯��ͼ1�����10��15minʱH2��Ũ��Ϊ1.6mol/L��
��0��10min��CH4��ʾ�ķ�Ӧ����Ϊ__________mol/(L��min)��
����ͼ1������a������b�ֱ��ʾ���¶�T1ʱ��ʹ��������ͬ���������ͬ�Ĵ���ʱ���ﵽƽ�������n(CH4)�仯���ߣ����б�ʾ����������ϴ�������� ________ (�a���� ��b��)��
��15minʱ�����ı���練Ӧ����������n(CH4)����ͼ1����ʾ�仯����ı������������_____________________________________(�δ�һ������)��
��3��ʵ����v����k��c2(CH4)��v����k��c(C2H4)��c2(H2)����k����k��Ϊ���ʳ��������¶��йأ�T1�¶�ʱk����k���ı�ֵΪ______ (����ֵ)�������¶���T1���ߵ�T2����Ӧ��������ı���v��____v��(�>����������<��)���жϵ�������_________________ ��
��4��������Ա����˼���ȼ�ϵ�ز����ڵ�⡣��ͼ2��ʾ��������Dz����� Y2O3�� ZrO2�Ĺ��壬���ڸ����´���O2����
��C����PtΪ______ ��(����������� )��
�ڸõ�ع���ʱ������Ӧ����ʽΪ_____________________��
���øõ�ص�ⱥ��ʳ��ˮ��һ��ʱ����ռ�����������������Ϊ112mL����������������Һ��25��ʱpH��_______ (������ǰ��NaCl��Һ�������Ϊ500mL)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������ȼ�����ʾ��ͼ���¡��õ���ܷ�ӦΪ��PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ������˵������ȷ����
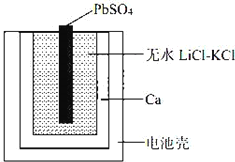
A. Ca�缫����������Ӧ
B. �����ĵ缫��Ӧ��Ca(s)+2Cl����2e��= CaCl2(s)
C. ���� LiCl �� KCl ˮ��Һ������ˮ LiCl��KCl
D. ����ˮLiCl��KCl������������ں��ز��ܹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣���¯����ʱ�ô�O2����������Ʒ�����ݲ��������ȷ���л������ɣ�����װ������ȼ�շ�ȷ���л������ʽ���õ�װ�ã�

��1��������O2�������ҵ�������ѡװ�ø����ܵ���ȷ����˳����
��2��Cװ����Ũ����������� ��
��3��Dװ����MnO2�������� ��
��4��ȼ�չ���CuO�������� ��
��5����ʵ������ȡ��Ʒֻ��C��H��O����Ԫ���е����ֻ����֣�ȷ��ȡ0.92g��Ʒ������ַ�Ӧ��A����������1.76g��B����������1.08g�������Ʒ��ʵ��ʽΪ ��
��6���������Dzⶨ����Է�������������ͼ����ʾ������ͼ������л������Է�������Ϊ ��
��7���ܷ����A��ʵ��ʽȷ��A�ķ���ʽ ���������������������������ܣ���A�ķ���ʽ�� �������ܣ���˿ղ����
��8�������ʵĺ˴Ź���������ͼ����ʾ������ṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com