
【题目】下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.反应2HI(g)![]() H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
C.合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率
D.用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
【答案】B
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;使用勒夏特列原理时,该反应必须是可逆反应,且平衡需发生移动。
A.工业生产硫酸的过程中使用过量的氧气,有利用平衡向正反应方向移动,可用勒夏特列原理解释,故A不选;
B. 反应2HI(g)![]() H2(g)+I2(g) 达平衡后,缩小反应容器体积,由于反应为等体积反应,平衡不移动,由于体积减小浓度增大混合气体颜色变深,不能用勒夏特列原理解释,故B正确;
H2(g)+I2(g) 达平衡后,缩小反应容器体积,由于反应为等体积反应,平衡不移动,由于体积减小浓度增大混合气体颜色变深,不能用勒夏特列原理解释,故B正确;
C. 合成氨工厂通常采用高压(20MPa50Mpa)条件,有利用平衡向正反应方向移动,可用勒夏特列原理解释,故C不选;
D.![]() ,用盐酸洗增大Cl-浓度,使平衡逆移,可以减少沉淀损失,可以用勒夏特列原理解释,故D正确;
,用盐酸洗增大Cl-浓度,使平衡逆移,可以减少沉淀损失,可以用勒夏特列原理解释,故D正确;
故答案选:B。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】1980年,古迪的夫发明了钴酸锂材料,这种材料的结构可以使锂离子在其中快速移动。以LiCoO2作电极材料的锂离子电池在充、放电时的微观粒子变化如图所示,下列说法正确的是
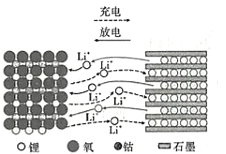
A.LiCoO2是电池的负极材料
B.充电时,LiCoO2电板的电势低于石墨电极
C.充电时,阳极发生的反应是LiCoO2+xe-=Li1-xCoO2+xLi+
D.放电时,当1mol电子转移,则石墨电极质量减少7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物广泛存在于人们的日常生活和工业生产中。回答下列问题:
(1)基态Fe原子的核外电子排布式是________,Ca元素与Fe元素同周期,灼烧![]() ,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
(2)人体内血红蛋白的结构简式如图所示:
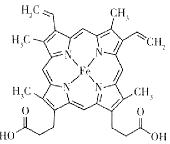
①组成血红蛋白的5种元素中,电负性由大到小的顺序是_________,C、N、O的第一电离能由大到小的顺序是_______。
②血红蛋白分子结构中N的杂化方式是_______。
③血红蛋白分子结构中含有配位键,为这些配位键提供孤电子对的元素是_______(写元素符号,下同),提供空轨道的元素是______。
(3)![]() 可应用于工业生产中的催化剂,其晶胞结构如图所示:
可应用于工业生产中的催化剂,其晶胞结构如图所示:
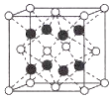
①已知电负性:Fe-1.83,Br-2.96,则![]() 中含有的化学键类型为_________。
中含有的化学键类型为_________。
②![]() 晶胞中铁的配位数是_________;
晶胞中铁的配位数是_________;![]() 晶胞边长为a cm,则
晶胞边长为a cm,则![]() 晶体密度的表达式为_____________
晶体密度的表达式为_____________![]() (设阿伏加德罗常数的值为NA)。
(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是( )
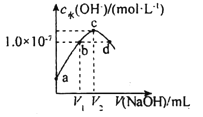
A.V1<10,V2=20
B.a点溶液的pH=3
C.c点溶液c水(H+)≈1.0×10-4mol·L-1
D.b、d点溶液均呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的含氧酸有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等多种,它们在工业上都是重要的化工原料。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式:_______。某温度下,0.01 mol L-1 H3PO3溶液的pH为2.7,该温度下,H3PO3 的一级电离常数 Kal=_______。 (已知:lg2 = 0.3,lg3 = 0.5,lg5 = 0.7,H3PO3 的第二步电离忽略不计)
(2)某实验小组用NaOH溶液处理含H3PO3废水,当溶液中c (Na+) =c(H2PO3-) + 2c(HPO32-)时,溶液呈______性(填“酸”“碱”或“中”)。
(3)已知:常温下,磷酸(H3PO4)的 Kal=7.ll×10-3、Ka2 = 6.23×10-8、Ka3 = 4.5 ×10-13, 则常温下,Na2HPO4溶液中H2PO4-、HPO42-和PO43-的浓度由大到小的顺序为________。
(4)向某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、H2PO4-、HPO42-和PO43-的物质的量分数为δ (平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_________。
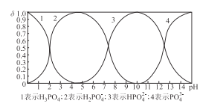
(5)已知:常温下,Ksp(FePO4) = l.3×10-22、Ksp(A1PO4) = 5.2 ×10-19。常温下,向含Fe3+、A13+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+):c(Al3+ ) =_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是
A. 与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积
B. 与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少
C. 深海地区石灰石岩层的溶解反应为:CaCO3(s)+H2O(l)+CO2(aq)Ca(HCO3)2(aq)
D. 海水呈弱酸性,大气中CO2浓度增加,会导致海水中CO![]() 浓度增大
浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),此电极反应式为_________。
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
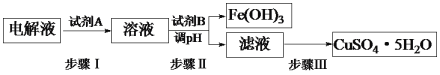
已知:几种金属阳离子开始沉淀和沉淀完全的pH。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.6 | 9.6 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
②步骤II中试剂B为_________(答出一种即可),调节pH的范围是___________;
③步骤III的操作是加热浓缩、___________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁电池因具有高的安全性和低廉的价格而备受关注,我国科学 家最近研发出一种新型镁电池,其工作原理如图所示。下列说法正确的是

A.I 室中的电解质溶液可以是稀 H2SO4
B.外电路中转移 2mol 电子时,N 极质量增加 24a g
C.离子交换膜为阳离子交换膜
D.电子流向:M 电极→I 室→离子交换膜→II 室→N 极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将SO2通入NaOH溶液得到一组c(H2SO3)+c(HSO3-)+c(SO32-)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如右下图所示。下列叙述正确的是
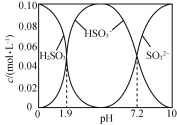
A.H2SO3的Ka2=10-7.2
B.pH=1.9的溶液中:c(Na+)>c(H2SO3)=c(HSO3-)> c(SO32-)
C.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
D.c(HSO3-)=0.050 mol·L-1的溶液中:c(H+)+c(Na+)<0.150 mol·L-1+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com