
����Ŀ�����ʵ������ڡ������ԡ�����ڻ�ѧ�����д��ں��ĵ�λ���������Ժ��ѧϰ�л���Ƶ��ʹ�á��Իش��������⣺
��1����������Ϊ14��15��N2��NO��ϣ�����������N2��NO�����ʵ���֮��Ϊ______________���û�������ƽ��Ħ������Ϊ______________________��
��2��1.7gNH3���״���µ�___________L��H2S��������Ŀ����ԭ�ӡ�
��3��һ���ܱ��������м���һ�����ɻ����ĸ��壨��ȿɺ��ԣ��������ֳ������֣�����߳���lmolN2���ұ߳���CO��CO2�Ļ�����干8gʱ�����崦����ͼλ�ã����������¶���ͬ�����Ҳ���������̼ԭ������ԭ�ӵĸ�����Ϊ________��
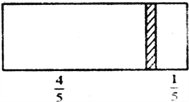
��4�����ᡢ��ˮ���ܶ�������ˮ���Ĺ�ϵ��ͼ��ʾ��ˮ���ܶ�Ϊ1g��cm-3���������ͼ����Ϣ���ش��������⣺
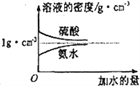
��֪����������Ϊ28%�İ�ˮ���ʵ���Ũ��Ϊ12mol��L-1������������Ϊ14%�İ�ˮ���ʵ���Ũ��______________(����ڡ�����С�ڡ����ڡ�)6 mol��L-1����֪4 mol��L-1��������Һ�ܶ�Ϊ��1�� 2 mol��L-1��������Һ�ܶ�Ϊ��2��100gŨ��Ϊ4 mol��L-1��������Һ��_____mLˮ��ϣ�ʹ��������ʵ���Ũ�ȼ�С��2mol��L-1�����ú���1����2��ʽ�ӱ�ʾ��
���𰸡� 1:1 29g/mol 3.36 4:5 ���� ![]()
����������1����������Ϊ14��15��N2��NO��ϣ�����������N2��NO�����ʵ���֮��Ϊ![]() ���û�������ƽ��Ħ������Ϊ
���û�������ƽ��Ħ������Ϊ![]() ����2��1.7gNH3�����ʵ�����1.7g��17g/mol��0.1mol������0.3mol��ԭ�ӣ����Ժ�����ͬ��ԭ�ӵ�H2S�����ʵ�����0.15mol����״���µ����Ϊ0.15mol��22.4L/mol��3.36L����3�����ݰ����ӵ����ɿ�֪����������������ʵ���֮����4��1�����Ի����������ʵ�����0.25mol��ƽ����Է���������8��0.25��32������ʮ�ֽ��淨��֪���ߵ����ʵ���֮����
����2��1.7gNH3�����ʵ�����1.7g��17g/mol��0.1mol������0.3mol��ԭ�ӣ����Ժ�����ͬ��ԭ�ӵ�H2S�����ʵ�����0.15mol����״���µ����Ϊ0.15mol��22.4L/mol��3.36L����3�����ݰ����ӵ����ɿ�֪����������������ʵ���֮����4��1�����Ի����������ʵ�����0.25mol��ƽ����Է���������8��0.25��32������ʮ�ֽ��淨��֪���ߵ����ʵ���֮����![]() �������Ҳ���������̼ԭ������ԭ�ӵĸ�����Ϊ4:5����4����ˮ���ܶ���Ũ�ȵ��������С�����28%�İ�ˮ�ܶ�С��14%��ˮ���ܶȡ�����
�������Ҳ���������̼ԭ������ԭ�ӵĸ�����Ϊ4:5����4����ˮ���ܶ���Ũ�ȵ��������С�����28%�İ�ˮ�ܶ�С��14%��ˮ���ܶȡ�����![]() ��֪�����������Ϊ28%�İ�ˮ���ʵ���Ũ��Ϊ12mol��L-1������������Ϊ14%�İ�ˮ���ʵ���Ũ�ȴ���6 mol��L-1������Ҫˮ�������VmL����
��֪�����������Ϊ28%�İ�ˮ���ʵ���Ũ��Ϊ12mol��L-1������������Ϊ14%�İ�ˮ���ʵ���Ũ�ȴ���6 mol��L-1������Ҫˮ�������VmL����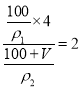 �����V��
�����V��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���������̼ԭ�ӿ϶�����ͬһƽ���ϵ��ǣ� ��
A.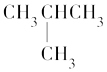
B.CH3CH=CHCH3
C.CH2=CHCH2CH3
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ�ͬλ�صķ��ֵ��ָ��ͬλ��ԭ������Ȼ״̬����ռ��
A.�����ٷֺ���B.����ٷֺ���
C.ԭ�Ӹ����ٷֺ���D.�ܶȰٷֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����ˮ�д����ܽ�ƽ�⣺AgClAg++Cl�� �� ����ͬ�¶��£��������Ȼ����ֱ������ͬ�����������Һ�У�Ag+��Ũ����С���ǣ� ��
A.0.1mol/L HCl
B.����ˮ
C.0.1mol/LAlCl3
D.0.1mol/LMgCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ���ǣ� ��
A.1����ϩ�ļ���ʽ�� ![]()
B.��ϩ�ķ���ʽ��CH2=CH2
C.��CHO�ĵ���ʽ�� ![]()
D.������ӵı���ģ��Ϊ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ȼ���MCl2����Ϊm�ˣ�����0.4molCl-,�����M��Ħ�������ɱ�ʾΪ�� ��
A. (m+71) g/mol B. 5m g/mol C. (5m-71) g/mol D. (5m-35.5) g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ���ǣ� ��
A. �ƺ���ˮ��Ӧ��Na��2H2O==Na+��2OH����H2��
B. ��������������������Һ��Al��2OH��==AlO2����H2��
C. ��Al2(SO4)3��Һ�м�������İ�ˮ��Al3����3NH3��H2O ��Al(OH)3��+ 3NH4+
D. �������ᷴӦ��2Fe+6H![]() =2Fe
=2Fe![]() +3H
+3H![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ���ܴﵽʵ��Ŀ���ǣ��г�����δ�������� ��
A. װ�����ڼ����������ȥ����
װ�����ڼ����������ȥ����
B. װ������ʯ�͵ķ���
װ������ʯ�͵ķ���
C. װ������ʵ������������
װ������ʵ������������
D. װ�ÿ�װ��֤�����ԣ����̼�����
װ�ÿ�װ��֤�����ԣ����̼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�����ӽ���Ĥ����ʯīΪ�缫��ⱥ��ʳ��ˮԭ��ʾ��ͼ����ͼ�ж�����˵������ȷ���ǣ� �� 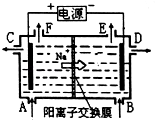
A.��״���£�����22.4LCl2��ͬʱ��2molNaOH����
B.��C����������NaOH��Һ
C.��E���ݳ���������H2
D.��F���ݳ���������Cl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com