
【题目】如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( ) 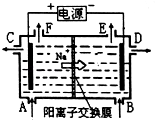
A.标准状况下,生成22.4LCl2的同时有2molNaOH生成
B.从C口流出的是NaOH溶液
C.从E口逸出的气体是H2
D.从F口逸出的气体是Cl2
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】物质的量属于“工具性”概念,在化学计算中处于核心地位,我们在以后的学习中还会频繁使用。试回答下列问题:
(1)将质量比为14∶15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______________,该混合气体的平均摩尔质量为______________________。
(2)1.7gNH3与标准状况下的___________L的H2S含有相数目的氢原子。
(3)一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入lmolN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同)。右侧混合气体中碳原子与氧原子的个数比为________。
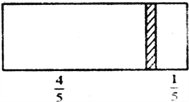
(4)硫酸、氨水的密度与所加水量的关系如图所示(水的密度为1g·cm-3),请根据图中信息,回答下列问题:
已知;质量分数为28%的氨水物质的量浓度为12mol·L-1,则质量分数为14%的氨水物质的量浓度______________(填“大于”、“小于”或“等于”)6 mol·L-1;己知4 mol·L-1的硫酸溶液密度为ρ1, 2 mol·L-1的硫酸溶液密度为ρ2。100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,使硫酸的物质的量浓度减小到2mol·L-1。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成.下列说法不正确的是( ) 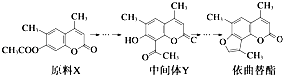
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去反应
D.1 mol依曲替酯只能与2 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4 , 其过程如下: I. 向软锰矿浆中通入SO2 , 锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2 , 充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.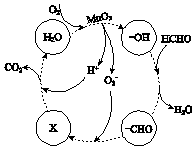
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4 , 该反应的化学方程式是 .
(2)II 中加入MnO2的主要目的是;调溶液 pH=4.7,生成的沉淀主要含有 和少量CaSO4 .
(3)III中加入阳离子吸附剂,主要除去的离子是 .
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2 . ①电解MnSO4溶液的离子方程式是
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是 , 总反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11.2L N2O4、NO2的混合气体中所含的氧原子数为NA
B. lmol Na 与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C. 向FeI2溶液中通入适量Cl2,当有lmolFe2+被氧化时,共转移的电子数目为NA
D. 高温下,0.2mol Fe与足量水蒸气反应,生成H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是
A.物质的量比为1∶1B.分子数比为16∶11C.体积比为1∶1D.体积比为11∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 
(1)肼燃料电池原理如图所示,N2H4通入的一极应为电池的极(填“正”或“负”).
(2)火箭常用N2O4作氧化剂,肼作燃料,已知: N2(g)+2O2(g)═2NO2(g)△H=﹣67.7kJmol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可用尿素[CO(NH2)2]和次氯酸钠﹣氢氧化钠溶液反应获得,请写出尿素法反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com