
【题目】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性碳催化下合成.
(1)实验室中常用来制备氯气的化学方程式为;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(△H)分别为﹣890.3kJmol﹣1、﹣285.8 kJmol﹣1和﹣283.0 kJmol﹣1 , 则生成1 m3(标准状况)CO所需热量为;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为;
(4)COCl2的分解反应为COCl2(g)═Cl2(g)+CO(g)△H=+108 kJmol﹣1 . 反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出): 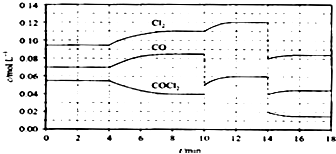
①计算反应在第8min时的平衡常数K=;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=molL﹣1
④比较产物CO在2﹣3min、5﹣6min和12﹣13min时平均反应速率[平均反应速率分别以v(2﹣3)、v(5﹣6)、v(12﹣13)表示]的大小;
⑤比较反应物COCl2在5﹣6min和15﹣16min时平均反应速率的大小:v(5﹣6) v(15﹣16)(填“<”、“>”或“=”),原因是 .
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)5.52×103KJ
(3)CHCl3+H2O2=HCl+H2O+COCl2
(4)0.234mol/L;<;0.031; v(5~6)>v(2~3)=v(12~13);>;在相同温度时,该反应的反应物浓度越高,反应速率越大
【解析】解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气与水制取氯气,反应方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)根据CH4、H2、和CO的燃烧热,可得热化学方程式:
MnCl2+Cl2↑+2H2O;(2)根据CH4、H2、和CO的燃烧热,可得热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=﹣571.6kJmol ﹣1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=﹣890.3kJmol﹣1;
③2CO(g)+O2(g)=2CO2(g)△H=﹣566.03kJmol﹣1,
根据盖斯定律,②﹣①﹣③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJmol ﹣1,
即生成2molCO,需要吸热247.3 KJ,那么要得到1立方米的CO,吸收热量为 ![]() ×
× ![]() =5.52×103KJ;
=5.52×103KJ;
所以答案是:5.52×103KJ;(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由﹣1价降低为﹣2价,生成H2O,由电子转移守恒与原子守恒可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成,故反应方程式为CHCl3+H2O2=HCl+H2O+COCl2,
所以答案是:CHCl3+H2O2=HCl+H2O+COCl2;(4)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K= ![]() =
= ![]() =0.234mol/L,所以答案是:0.234mol/L;
=0.234mol/L,所以答案是:0.234mol/L;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
所以答案是:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故: ![]() =0.234mol/L,解得c(COCl2)=0.031mol/L;
=0.234mol/L,解得c(COCl2)=0.031mol/L;
所以答案是:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),
所以答案是:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
所以答案是:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
【考点精析】通过灵活运用化学平衡状态本质及特征和化学平衡的计算,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到限度的标志是( )
2AB(g)达到限度的标志是( )
A. 单位时间内生成n mol A2同时生成n mol AB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O﹣CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( ) 
A.X是电源的负极
B.阴极的反应式是:H2O+2e﹣═H2+O2﹣ , CO2+2e﹣═CO+O2﹣
C.总反应可表示为:H2O+CO2 ![]() H2+CO+O2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.Na2O、Na2O2、Fe2O3都是碱性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.纯碱、烧碱、熟石灰都是碱
D.水玻璃、氯水、漂白粉均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu与Zn用导线连接后浸入稀硫酸组成原电池装置。下列说法正确的是
A. 锌为负极,铜为正极
B. 铜片溶解,锌片上产生气体
C. 电子由铜极流出经导线流向锌极
D. 溶液中SO42-定向移向铜极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氟、氯、溴、碘的下列说法中,错误的是( )
A.原子半径依次减小B.原子核外电子层数依次增多
C.它们最外层电子数都是7D.原子核对最外层电子的引力依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al3++3H2O ![]() Al(OH)3+3H+的平衡体系中,要抑制Al3+的水解,可采取的措施为( )
Al(OH)3+3H+的平衡体系中,要抑制Al3+的水解,可采取的措施为( )
A.加热
B.通入氯化氢气体
C.加入适量的氢氧化钠溶液
D.加入固体AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工初始原料,可以由它出发合成很多有机产品,油漆软化剂丁烯酸乙酯的合成途径如下:

完成下列填空:
(1)丁烯酸乙酯的结构简式为______________________________。
(2)C→D的反应类型是____________。
A→B的化学方程式为___________________________________。
(3)写出一种D的同分异构体(与D含有完全相同的官能团)。_________________________________________
(4)请设计实验,检验D是否完全氧化为丁烯酸。____________________________
(5)设计一条由C制备ClCH2CH=CHCH2Cl的合成路线。(合成路线常用的表示方式为:A ![]() B
B ![]() 目标产物)_____________
目标产物)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于放热反应,又属于氧化还原反应的是( )
A.氨气与稀硫酸的反应B.SO3 溶于水生成硫酸
C.灼热的炭与二氧化碳的反应D.甲烷在氧气中燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com