
【题目】某学生化学课外兴趣小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,进行了下列实验探究。
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为 ;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如下装置(夹持仪器未画)进行定性实验;
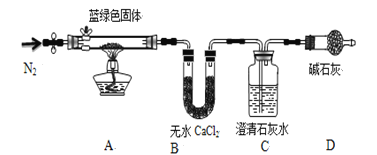
【问题讨论】
(1)假设2中的沉淀为 ,提出该假设的理论依据是 ,
(2)步骤1用无水乙醇洗涤,再风干的目的 ,
(3)装置D装有碱石灰的干燥管所起的作用是 ,
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设 (填写序号)一定不成立
(5)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是 (填代号)
A.浓硫酸 B.无水CuSO4 C.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是 (双选,填代号)
溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 ,
【答案】
(1)Cu(OH)2;碳酸根水解,溶液中含有较多的OH—
(2)利用乙醇的易挥发,带走洗涤的水
(3)防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果
(4)假设2;(5)b;(6)a c
(7)2 CuCO33Cu(OH)2或3Cu(OH)22 CuCO3或Cu5 (OH)6(CO3)2
【解析】
试题分析:(1)CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,可能是反应生成了碳酸铜沉淀,或双水解生成了氢氧化铜沉淀,或是碱式碳酸铜,因此假设1中沉淀为CuCO3,假设2为,Cu(OH)2;故答案为:Cu(OH)2;碳酸根水解,溶液中含有较多的OH—;
(2)步骤1用无水乙醇洗涤,乙醇的易挥发,风干时容易带走洗涤的水,故答案为:利用乙醇的易挥发,带走洗涤的水;
(3)装置D装有碱石灰的干燥管可以防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果,故答案为:防止外界空气中的二氧化碳及水蒸气加入C中,影响实验结果;
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明生成了二氧化碳气体,证明假设2一定不成立,故答案为:假设2;
(5)实验验证碳酸铜或氢氧化铜是利用受热分解生成的产物性质验证,加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,加热氢氧化铜时生成水蒸气和黑色氧化铜,所以需要验证水的存在和二氧化碳的存在就可以证明产生的物质成分,装置A中加热是否变化为黑色固体,装置B选择无水硫酸铜验证是否生成水,澄清石灰水是否变浑浊证明是否生成二氧化碳,所以要将上图中B装置的试剂改用无水CuSO4,故选b;
(6)①Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;氢氧化钙为强碱,CaCO3的溶解度和BaCO3溶解度相差不大,故答案为:ac;
(7)B中吸收的是水,水的物质的量=![]() =0.15mol,C中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量=
=0.15mol,C中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量=![]() =0.1mol,氧化铜的物质的量=
=0.1mol,氧化铜的物质的量=![]() =0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2,故答案为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2。
=0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2,故答案为:2 CuCO33Cu(OH)2 或 3Cu(OH)22 CuCO3 或 Cu5(OH)6(CO3)2。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H =-196 kJ/mol
2SO3(g) △H =-196 kJ/mol
请填空:(填>、=、<;增大、减小、不变)
(1)当容器体积不变,①向容器中充入1mol SO2和0.5mol O2,②向容器中充入1mol SO3。两种情况下反应分别达到平衡后,放出和吸收的热量分别为Q1和Q2,则Q1+Q2____________98KJ。
①中达到平衡后,再向容器中加入1mol SO2和0.5mol O2,重新达到平衡,O2体积分数___________。
②中达到平衡后分离出部分SO3,重新平衡后,SO3的浓度________。
(2)保持压强不变,①向容器中充入1mol SO2和0.5mol O2,②向容器中充入1mol SO3,反应达到平衡时,SO2和O2的转化率前者________后者;再向容器中充入1mol SO2和0.5mol O2,重新达到平衡后,SO2的浓度________、O2物质的量_________原平衡的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是 ( )
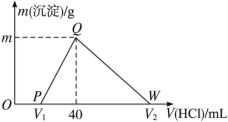
A.原合金质量为0.92 g B.图中V2为100
C.沉淀的质量m为1.56 g D.OP段发生的反应为:OH-+H+=== H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 热化学方程式中的化学计量数表示物质的量,可以是分数
C. 中和热可以选用稀H2SO4与稀Ba(OH)2溶液进行实验测定
D. HCl和NaOH反应的中和热ΔH =-57.3kJ/mol,则NaOH和CH3COOH反应的中和热ΔH<-57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) ![]() xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
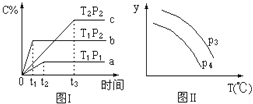
A.P3<P4,y轴表示B的转化率
B.P3<P4,y轴表示B的体积分数
C.P3>P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的△H=-122kJmol-1,△S=+231Jmol-1K-1,则此反应在下列哪种情况下可自发进行( )
A. 在任何温度下都能自发进行 B. 在任何温度下都不能自发进行
C. 仅在高温下自发进行 D. 仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是298 K时N2与H2反应过程中能量变化曲线。下列叙述正确的是( )

A.该反应的热化学方程式为N2+3H2![]() 2NH3 ΔH=-92 kJ·mol-1
2NH3 ΔH=-92 kJ·mol-1
B.b曲线是加入催化剂时的能量变化曲线,加入催化剂,该化学反应的反应热发生改变
C.298 K时、在一体积一定的密闭的容器中,充入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,充入2mol NH3反应后吸收的热量为Q2 kJ,则Q1 = Q2 = 92 kJ
D.298 K时、在一体积一定的密闭的容器中,充入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,充入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为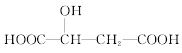 ,下列说法正确的是( )
,下列说法正确的是( )
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
D.![]() 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com