
【题目】已知有以下物质相互转化:
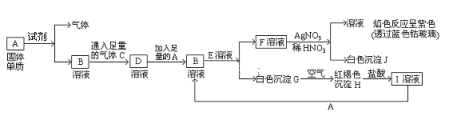
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式)___________;
(2)写出B的化学式___F的化学式____;
(3)写出由G转变成H的化学方程式___________________;
(4)写出检验I溶液中阳离子的试剂_____________;向I溶液中加入A的有关离子反应方程式是______。
【答案】(1) HCl (2) FeCl2KCl (3) 4Fe(OH)2+O2+ 2H2O = 4Fe(OH)3
(4)Fe3+3SCN- = Fe(SCN)32Fe3+ + Fe = 3Fe2+
【解析】
试题解析:F与硝酸酸化的硝酸银溶液产生白色沉淀J,则F中含有氯离子,J是AgCl,所得溶液焰色反应呈紫色,则溶液中含有钾离子,根据元素守恒知,F为KCl,白色沉淀G在空气中转化为红褐色沉淀H,则G是Fe(OH)2,H是Fe(OH)3,氢氧化铁和盐酸反应生成氯化铁和水,则I是FeCl3;B和E发生复分解反应生成KCl和Fe(OH)2,且氯化铁和A反应生成B,则B为FeCl2,A是Fe,E为KOH,由A与试剂反应生成B与气体,则试剂为盐酸、气体为氢气,B与足量的气体C反应生成I,则C为氯气,(1)通过以上分析知,A转化为B及气体这步反应中应加入的试剂是盐酸,故答案为:HCl;(2)由上述分析可知,B的化学式为FeCl2,F的化学式KCl,故答案为:FeCl2;KCl;(3)Fe(OH)2被氧气氧化生成氢氧化铁,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)I是FeCl3,铁离子和硫氰化钾溶液反应生成血红色溶液,所以铁离子可以用硫氰化钾溶液检验,反应离子方程式为:Fe3++3SCN-=Fe(SCN)3;氯化铁和铁反应生成氯化亚铁,反应离子反应方程式为2Fe3++Fe=3Fe2+,故答案为:Fe3++3SCN-=Fe(SCN)3;2Fe3++Fe=3Fe2+。


科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4一,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
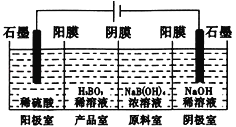
A. 当电路中通过1mol电子时,可得到lmolH3BO3
B. 将电源的正负极反接,工作原理不变
C. 阴极室的电极反应式为:2H2O-4e-=O2+4H+
D. B(OH)4一穿过阴膜进入阴极室,Na+穿过阳膜进入产品室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为_________,其中CH4和CO2的物质的量之比为_____。
(2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。
(3)在标准状况下,VL某气体(摩尔质量为M g/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=__________mol/L(用以上字母表示,且必须化简)。
(4)实验室用MnO2与浓盐酸制取Cl2,发生反应的化学方程式:_____。ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式________________。生成0.2molClO2转移的电子数目为_____________。
(5)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:

请回答下列问题:
(1)整套实验装置的连接顺序是f接( )( )接( )( )接( )(填各接口处的字母代号)。
(2)E装置中制取氯气的离子方程式是 。
(3)A装置中试剂X是 。
(4)C装置中的现象是 产生此现象的原因是 (用离子方程式和必要的文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓硫酸与Cu反应的叙述正确的是( )
A. 在反应中,浓硫酸只表现出氧化性
B. 该反应中还原剂与氧化剂物质的量之比为1:2
C. 在反应中,浓硫酸既表现出氧化性,又表现出酸性
D. 每1 mol 铜参加反应就有2 mol浓硫酸被还原,同时生成2 mol SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
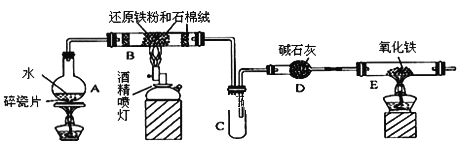
(1)装置B中发生反应的化学方程式是________________________________;
(2)装置E中的现象是______________________________________________。
(3)装置C中右侧导管为什么既不插入试管底部,又不只进入试管一点点,其主要原因是___________.
(4)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①步骤一中通入足量Cl2发生反应的离子方程式为_______________________________________。
②步骤二,从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A. 反应在c点达到平衡状态
B. 反应物浓度:a点小于b点
C. 反应物的总能量低于生成物的总能量
D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
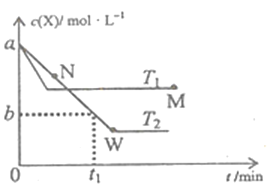
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
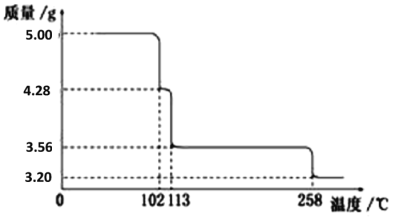
请回答下列问题:
(1)试确定110℃时固体物质的化学式_____________________;
(2)取200℃所得样品,加热至280oC, 该反应的化学方程式为:_______________;
(3)将280oC所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为______________。
(4)把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体其存在的最高温度是______;
(5)天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为amol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com