
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4一,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
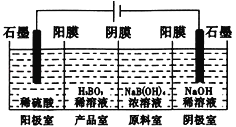
A. 当电路中通过1mol电子时,可得到lmolH3BO3
B. 将电源的正负极反接,工作原理不变
C. 阴极室的电极反应式为:2H2O-4e-=O2+4H+
D. B(OH)4一穿过阴膜进入阴极室,Na+穿过阳膜进入产品室
【答案】A
【解析】
阳极电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为4H2O+4e-=2H2↑+4OH-,阳极室中的氢离子通入阳膜进入产品室,B(OH)4一穿过阴膜进入产品室,发生反应:B(OH)4一+H+=H2O+H3BO3,据此判断。
A.阳极发生失去电子的氧化反应,电极反应式为2H2O-4e-=O2↑+4H+,电路中通过1mol电子时有1molH+生成,硼酸(H3BO3)为一元弱酸,生成1mol硼酸需要1molH+,所以电路中通过1mol电子时,可得到1molH3BO3,A正确;
B.根据以上分析可知如果将电源的正负极反接,工作原理发生变化,B错误;
C.电解时阴极发生得到电子的还原反应,电极反应式为4H2O+4e-=2H2↑+4OH-,C错误;
D.阳极电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为4H2O+4e-=2H2↑+4OH-,阳极室中的氢离子通入阳膜进入产品室,B(OH)4一穿过阴膜进入产品室,发生反应:B(OH)4一+H+=H2O+H3BO3,Na+穿过阳膜进入阴极室,D错误;
答案选A。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】在一固定休积的密闭容器中,充入2molA和1molB,发生如下反应2A(g)+B(g)![]() xC(g) 平衡后,C的体积分数为W%,若维持容器容君和温度不变,0.6molA、0.3molB和1.4molC为起始物质。达到平衡后,C的体形分數也为W%。平衡后若缩小容器体积,C的体和分数C%、混合气体平均相对分子质量(M)、平衡常数(K)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
xC(g) 平衡后,C的体积分数为W%,若维持容器容君和温度不变,0.6molA、0.3molB和1.4molC为起始物质。达到平衡后,C的体形分數也为W%。平衡后若缩小容器体积,C的体和分数C%、混合气体平均相对分子质量(M)、平衡常数(K)和正反应速率[V(正)],随压强(P)的变化,一定符合的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A<C<B
D. D点溶液中:c(Cl-)+ 2c(H+)=2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的溶液,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).

(2)容量瓶上需标有以下6项中的______(填序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
(3)容量瓶不能______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(4)在配制过程中,下列操作中能引起误差偏高的有______(填代号).
①未等稀释后的溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
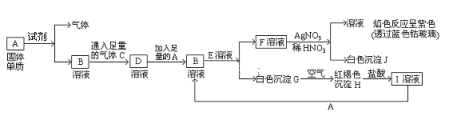
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式)___________;
(2)写出B的化学式___F的化学式____;
(3)写出由G转变成H的化学方程式___________________;
(4)写出检验I溶液中阳离子的试剂_____________;向I溶液中加入A的有关离子反应方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com