
【题目】某温度时,在一个2L的密闭容器中,X,Y,Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: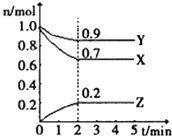
(1)该反应在min时达到化学平衡状态.
(2)该反应的化学方程式是 .
(3)从开始到2min,Z的平均反应速率是 .
【答案】
(1)2
(2)3X+Y2Z
(3)0.05mol/(L.min)
【解析】解:(1)可逆反应达到平衡状态时,各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,根据图知,当2min时各物质的物质的量不变,则此时该反应达到平衡状态,故答案为:2;(2)同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,根据图知,该反应中参加反应的△n(X)=(1.0﹣0.7)mol=0.3mol、△n(Y)=(1.0﹣0.9)mol=0.1mol、△n(Z)=(0.2﹣0)mol=0.2mol,则X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,则该反应方程式为3X+Y2Z,故答案为:3X+Y2Z;(3)v(Z)= ![]() =
= ![]() =0.05mol/(L.min), 故答案为:0.05mol/(L.min).
=0.05mol/(L.min), 故答案为:0.05mol/(L.min).
(1)可逆反应达到平衡状态时,各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;(2)同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,根据图知,该反应中参加反应的△n(X)=(1.0﹣0.7)mol=0.3mol、△n(Y)=(1.0﹣0.9)mol=0.1mol、△n(Z)=(0.2﹣0)mol=0.2mol,则X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2;(3)根据v= ![]() 计算前2min内Z的平均反应速率.
计算前2min内Z的平均反应速率.


科目:高中化学 来源: 题型:
【题目】某铝合金中含有元素铝、铁、铜、硅。为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag(精确到0.1g),称量时通常使用的主要仪器的名称是_______。
(2)将样品溶解于足量的稀盐酸,过滤并洗涤滤渣。溶解、过滤用到的玻璃仪器有_______。(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣,生成沉淀的离子方程式是___________。
(5)将步骤(4)的滤渣烘干并灼烧至恒重、冷却后称重,其质量为bg。有关反应的化学方程式是_______________,原样品中铝的质量分数是_______。(用含a、b的代数式表示)
(6)若步骤(5)的滤渣灼烧不充分,则实验结果______(填“偏高”、“偏低”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1molL﹣1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) .
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号) .
(3)已知t℃时,Kw=1×10﹣12 , 则t℃(填“>”“<”或“=”)25℃;在t℃时溶液呈中性的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在银锌原电池中,以硫酸铜为电解质溶液,锌为_____极,电极上发生的是_____反应(“氧化”或“还原”).电极反应式为_____,锌片上观察到的现象为_____银为_____极,电极上发生的是_____反应(“氧化”或“还原”),电极反应式是_____,银片上观察到的现象是_____.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由基本有机化工原料A(C2H2)制备有机物D和聚异戊二烯的合成路线如图所示: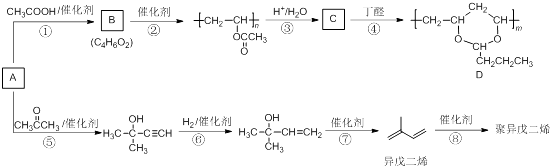
完成下列填空:
(1)上述转化步骤中与反应①的反应类型相同的是(填编号).
(2)m与n的关系为 .
(3)异戊二烯分子中最多有个原子共平面.
(4)在异戊二烯的同分异构体中,与A具有相同官能团且分子中有支链的有机物的名称是 .
(5)参照流程图中异戊二烯的合成路线,若把步骤⑤中的反应物丙酮改为乙醛,则经过反应⑤、⑥、⑦后得到的有机物是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是
A.“84 消毒液”和酒精混合使用可增强杀菌消毒能力
B.通过煤干馏原理可得到苯、二甲苯等有机物
C.纤维素在人体内可水解为葡萄糖,故可作为人体的营养物质
D.铝是地球上含量最多的金属元素,最早被人类大规模开发利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中逐滴加入 NaOH 溶液,生成沉淀的物质的量与加入的 NaOH 溶液体积的变化关系如图所示。则下列说法不正确的是( )
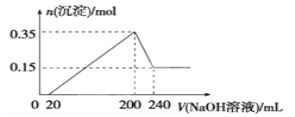
A. 镁和铝的总质量为9 g
B. 生成的氢气在标准状况下的体积为11.2 L
C. 最初20 mL NaOH溶液用于中和过量的硫酸
D. 氢氧化钠溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止人们已发现或合成了118种元素,元素①-⑨在周期表中的位置如下表所示(序号代表对应的元素)。
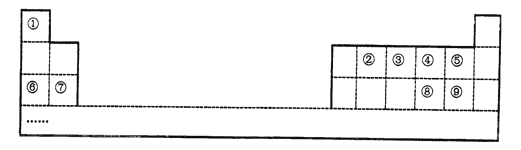
(1)②在周期表中的位置_________
(2)元素⑤、⑧、⑨中,原子半径从大到小的顺序是________(用元素符号表示)
(3)⑥与⑦的最高价氧化物对应的水化物的碱性强弱为______。(填化学式)
(4)①分别与②③④⑤形成的化合物中,最稳定的物质的化学式是______.
(5)能说明⑨的非金属性比③强的化学方程式为_______
(6)化合物甲是元素③形成的最简单氢化物,甲的电子式是___。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com