
【题目】I.血液中的钙离子平衡在临床医学中具有重要的意义。某研究小组为测定血液样品中Ca2+的含量,进行的实验如下:
①量取5.0mL血液样品,处理后配制成100mL溶液;
②量取10.0mL溶液,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得的CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入0.001mol/L的酸性KMnO4溶液,使H2C2O4完全氧化,同时产生使澄清石灰水变浑浊的无色无味气体,消耗酸性KMnO4溶液的体积为2.00mL.
(1)步骤①中用到的玻璃仪器有玻璃棒、烧杯、量筒、________。
(2)步骤②中发生反应的离子方程式为_______________。
(3)血样中Ca2+的含量为___g/L。
II.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化。据此回答下列问题:

(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_________。
(2)根据上述框图反应关系,写出①、②、③3个反应的离子方程式:①_____________;②_____________;③_____________;
【答案】 胶头滴管、100 mL容量瓶 Ca2++C2O![]() =CaC2O4↓ 0.4 过滤 Al2O3+2OH-=2AlO2-+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ AlO2- +H+ +H2O= Al(OH)3↓
=CaC2O4↓ 0.4 过滤 Al2O3+2OH-=2AlO2-+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ AlO2- +H+ +H2O= Al(OH)3↓
【解析】I.(1)量取5.0mL血液样品,处理后配制成100mL溶液,依据配制溶液的过程选择所需仪器,量取需要量筒,溶解需要烧杯和玻璃棒,转移需要100mL容量瓶,定容需要胶头滴管,用到的玻璃仪器有:玻璃棒、烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(2)取10.0mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀,是钙离子和草酸根离子结合生成,反应的离子方程式为:Ca2++C2O42-=CaC2O4↓,故答案为:Ca2++C2O42-=CaC2O4↓;
(3)草酸具有还原性能被酸性高锰酸钾溶液氧化使H2C2O4完全被氧化,生成二氧化碳,依据原子守恒和电荷守恒配平得到离子方程式为:2MnO4-+5H2C2O4+6H+ ═10CO2↑+2Mn2+ +8H2O。根据反应的离子方程式
2MnO4- + 5H2C2O4+6H+═10CO2↑+2Mn2++8H2O
2 5
0.0010mol/L×0.002L n(H2C2O4)
n(CaC2O4)=n(H2C2O4)=n(Ca2+)=5×10-6mol,5.0mL血液中含钙离子物质的量5×10-6mol×![]() =5×10-5mol,血样中Ca2+的含量=
=5×10-5mol,血样中Ca2+的含量=![]() =4×10-4g/mL=0.4 g/L,故答案为:0.4;
=4×10-4g/mL=0.4 g/L,故答案为:0.4;
II.由流程可知,Al2O3和Fe2O3不溶于水,则沉淀C为Al2O3和Fe2O3,氧化铁与碱不反应,则沉淀D为Fe2O3,反应②③中生成的沉淀为Al(OH)3,受热分解生成B为Al2O3,反应②为KAl(SO4)2、氨水的反应,则溶液E为K2SO4、(NH4)2SO4、NH3·H2O,由上述分析可知,B为Al2O3,D为Fe2O3,E为K2SO4、(NH4)2SO4、NH3·H2O,
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离方法为过滤,故答案为:过滤;
(2)反应①为:Al2O3+2OH-=2AlO2-+H2O,反应②为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,反应③为:AlO2-+H2O+H+=Al(OH)3↓,故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;AlO2-+H2O+H+=Al(OH)3↓。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】某同学用10mol/L的浓盐酸配制230mL1mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸___________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等。
(3)若实验遇下列情况,溶液的物质的量浓度是: ①偏高 ②偏低 ③不变
A、加水定容时越过刻度线_________(填序号)。
B、忘记将洗涤液转入容量瓶__________(填序号)。
C、容量瓶内壁附有水珠而未干燥处理__________ (填序号)。
D、量取的浓盐酸置于烧杯中较长时间后配制__________ (填序号)。
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,若锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2NaClO3 + H2SO4 + SO2===2ClO2 + 2NaHSO4,下列叙述正确的是
A. NaClO3是还原剂 B. SO2被氧化 C. SO2发生还原反应 D. ClO2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

(1)在通常状况下,金刚石和石墨相比较,____________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________________。
(2)12 g石墨在一定量的空气中燃烧,生成气体36 g,该过程放出的热量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
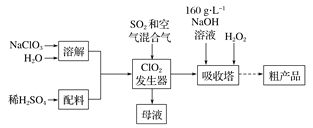
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是 ( )
A. (NH4)2SO4溶于水:(NH4)2SO4===2NH![]() +SO
+SO![]()
B. HF溶于水:HF+ H2O ![]() H 3O++F-
H 3O++F-
C. H3PO4溶于水:H3PO4![]() 3H++PO
3H++PO![]()
D. NaHS溶于水:NaHS===Na++HS-,HS-![]() H++S2-
H++S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com