
有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫红色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验④中的离子反应方程式 ,
(3)不能确定是否存在的离子有__________________________。请设计简单实验方案证明它(们)是否存在(写出实验方法、现象、结论)__________ _________。
(1)H+、I-、NH4+(1分) Cu2+、CO32-、Mg2+ (1分)
(2)NH4++OH- NH3↑+H2O(2分)
NH3↑+H2O(2分)
(3)K+、Na+(1分) 做焰色反应实验,有黄色火焰则含Na+,无黄色火焰则不含Na+,透过蓝色钴玻璃观察,有紫色火焰则含K+,无紫色火焰则不含K+(2分)
解析试题分析:根据实验①现象:溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-发生反应而不能共存,说明溶液中肯定不含有CO32-;根据实验②现象:CCl4层呈紫红色,说明有I2生成,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-;根据实验③现象:溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Mg2+、Cu2+能与碱反应产生沉淀,说明溶液中肯定不含有Mg2+、Cu2+;根据实验④现象:产生的气体能使湿润的红色石蕊试纸变蓝,该气体为氨气。这是由于 NH4++0H- NH3↑+H20,因此溶液中肯定含有NH4+,总上所述,在提供的离子中肯定含有的离子为:H+、I-、NH4+;肯定不含有的离子为:Mg2+、Cu2+、CO32-,还不能确定的离子为:K+、Na+;要确定K+、Na+,则需要通过焰色反应来完成,即做焰色反应实验,有黄色火焰则含Na+,无黄色火焰则不含Na+,透过蓝色钴玻璃观察,有紫色火焰则含K+,无紫色火焰则不含K+。
NH3↑+H20,因此溶液中肯定含有NH4+,总上所述,在提供的离子中肯定含有的离子为:H+、I-、NH4+;肯定不含有的离子为:Mg2+、Cu2+、CO32-,还不能确定的离子为:K+、Na+;要确定K+、Na+,则需要通过焰色反应来完成,即做焰色反应实验,有黄色火焰则含Na+,无黄色火焰则不含Na+,透过蓝色钴玻璃观察,有紫色火焰则含K+,无紫色火焰则不含K+。
考点:考查离子共存、离子检验的实验判断


科目:高中化学 来源: 题型:填空题
正三价铁元素有一定的氧化性,FeCl3溶液吸收一定量SO2后溶液颜色发生变化。
(1)反应的离子方程式为_________________________________________________。
(2)除H+,OH-,H2O外,溶液中一定含有的微粒有________。
| A.Fe2+ | B.Fe3+ | C.Cl- | D.SO42— E.H2SO3 |
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)写出亚硝酸的电离方程式: 。
(2)在酸性条件下,当NaNO2与KI按物质的量之比1∶1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为 (填化学式)。
(3)要得到稳定的HNO2溶液,可以向冷冻的NaNO2浓溶液中加入或通入某种物质,下列物质不适合的是 (填字母)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(4)碱性工业废水中的N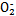 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
①写出上述反应的离子方程式: 。
②发生上述反应后废水的pH将 (填“增大”“减小”或“不变”)。
(5)酸性工业废水中的N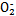 可用尿素除去。尿素
可用尿素除去。尿素
(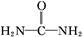 )与N
)与N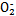 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式: ;
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;在下面的化学式上标出电子转移的方向和数目2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+ Na2SO4 + 2 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验: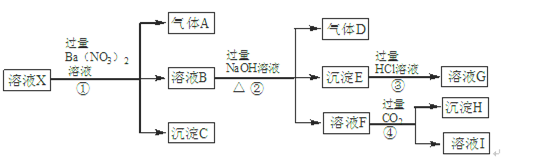
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是 ,不能确定是否含有的离子是 ,若要确定是否含有这种离子,最可靠方法是:
。
(2)溶液I中所含溶质有 (填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是 (填序号)。
(4)步骤①中生成气体A的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-. 现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- : ,原因是 .
(2)由第二份进行的实验可知混合物中应含有 离子,其物质的量浓度为 .
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量。(要求计算过程)
(4)综合上述实验,你认为以下结论正确的是
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一包白色粉末,可能含有 Na2SO4、NaHCO3、KCl、Ba(OH)2、CuSO4中的一种或几种,按以下步骤进行实验:
①将此粉末溶于水,得到无色溶液和白色沉淀;
②将足量稀盐酸加入白色沉淀中,沉淀部分溶解,并有气泡产生。
⑴根据上述实验现象,判断此粉末中一定含有的物质是 ,一定没有的物质是(均填写化学式)。
⑵上述实验中第②步反应的离子方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至过量。
(1)写出可能发生的有关反应的化学方程式。 。
(2)在图中,纵坐标表示生成沉淀的物质的量,横坐标表示加入Ba(OH)2的物质的量。试在图中画出当溶液中明矾为1 mol时,生成的每一种沉淀的物质的量随Ba(OH)2物质的量变化的曲线(在曲线上标明沉淀的化学式)。
(3)向a L物质的量浓度为M mol/L的明矾溶液中滴加物质的量浓度为n mol/L的Ba(OH)2溶液b L,用含a、M、n的表达式表示:
①当b满足________条件时,沉淀的总物质的量为最大值;
②当b满足________条件时,沉淀的质量为最大值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com