
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验: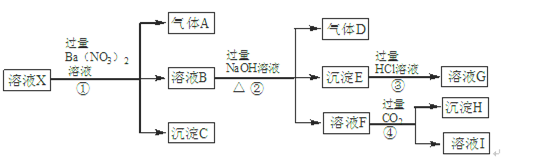
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是 ,不能确定是否含有的离子是 ,若要确定是否含有这种离子,最可靠方法是:
。
(2)溶液I中所含溶质有 (填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是 (填序号)。
(4)步骤①中生成气体A的离子方程式是 。
(1)Ba2+、CO32-、SiO32-、NO3- (每个1分,共4分) Fe3+(1分)
取少量X溶液于试管中,在其中滴加几滴KSCN溶液,若溶液不显血红色则说明没有Fe3+,若显血红色则说明含有Fe3+(2分)
(2)NaNO3、NaHCO3、Ba(NO3)2 (CO2、H2CO3不作要求)(每个1分,共3分)
(3)④(1分) (4)3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O (2分)
解析试题分析:(1)题干中强酸性溶液中一定不含CO32-、SiO32-;NO3-与Fe2+不能同时存在;根据转化关系中X溶液中加入过量硝酸钡生成气体沉淀和溶液的反应,依据离子性质推断溶液中一定含Fe2+,一定不含NO3?;酸性溶液中硝酸根离子具有强氧化性,加入Ba(NO3)2后得到气体A为NO,D为NO2;沉淀C为硫酸钡,判断溶液中一定含SO42-;根据离子共存判断原溶液中一定不含Ba2+;溶液B中一定含有Fe3+;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+;生成的沉淀E是Fe(OH)3;与碱反应生成的气体D为NH3;溶液F通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-;证明原溶液中一定含有Al3+;沉淀H为Al(OH)3;原溶液中一定含有Al3+、NH4+、Fe2+、SO42-;一定不含Ba2+、CO32-、SiO32-、NO3-;可能含有的Fe3+;用KSCN溶液可检验是否含有Fe3+。
(2)溶液F加入过量的CO2得到的溶液I,一定含有生成的NaHCO3、第①②步剩余和生成的NaNO3和Ba(NO3)2。
(3)①为Ba2+与SO42?反应、NO3?和H+氧化Fe2+;②NaOH与NH4+和Fe3+反应;③为Fe(OH)3与HCl的反应;④为CO2、H2O与AlO2-生成Al(OH)3的反应,所以符合“强酸制弱酸”反应为④。
(4)步骤①中生成气体A为NO3?、H+氧化Fe2+,配平可得离子方程式:)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 。
考点:本题考查离子的推断、离子方程式的书写。


科目:高中化学 来源: 题型:填空题
Ⅰ.小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式: 。
Ⅱ.氨气通入水中可制得氨水,氨水能使无色的酚酞变红。请写出实验室制取氨气的化学方程式: ,
检验氨气的一种化学方法是: 。
Ⅲ.火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S=K2S+2NO2↑+CO2↑。其中氧化剂是 ;还原剂是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式: ;
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是 ;
此时最好用含氢氧化铝的胃药(如胃舒平),写出其反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出下列反应的离子反应方程式(全对得10分,有错即为0分)
(1)NaAlO2溶液中加入少量的盐酸
(2)AlCl3溶液中加入过量的NaOH
(3)Al2O3与NaOH水溶液的反应
(4)Fe3O4溶解在稀盐酸中
(5)FeCl2溶液中加入酸化的H2O2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫红色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验④中的离子反应方程式 ,
(3)不能确定是否存在的离子有__________________________。请设计简单实验方案证明它(们)是否存在(写出实验方法、现象、结论)__________ _________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
七种物质回答问题:① 氢氧化钠固体 ② 铜丝 ③ 氯化氢气体 ④ 稀硫酸溶液 ⑤ 二氧化碳气体 ⑥ 蔗糖晶体 ⑦ 熔融氯化钠
属于电解质的是: (填编号,下同),属于非电解质的是 ,能导电的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有十种物质:①铁丝;②CO气体;③CO2气体;④硫酸;⑤CaO固体;⑥盐酸;⑦(NH4) 2SO4晶体;⑧熔融NaOH;⑨液态氯化氢;⑩酒精,以上物质中:
(1)属于非电解质的有 (填代号),属于酸性氧化物的有 (填代号),题中所示状态能导电且属于电解质的有 (填代号)。
(2)属于盐的物质其电离方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种可溶性盐,知其阳离子分别是Na+、Ba2+、Cu2+、Ag+ 中的某一种,
阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。现做以下实验:
① 将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
② 分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:
A 、B 、C 、 D 。
(2)写出实验步骤②中涉及到的所有反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅孔雀石是一种含铜的矿石,含铜形态为
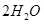 ,同时含有
,同时含有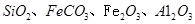 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图: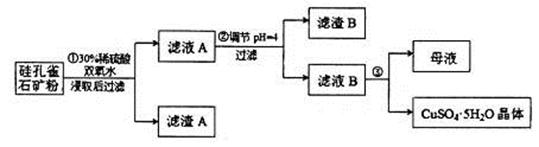
请回答下列问题:
(1)完成步骤①中稀硫酸与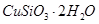 发生反应的化学方程式
发生反应的化学方程式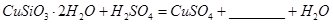 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A.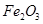 | B.CuO | C.A12O3 | D.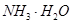 |
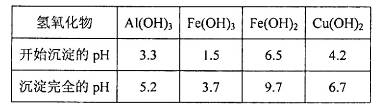
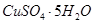 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,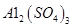 饱和溶液中
饱和溶液中 mol
mol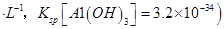 ______________。
______________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com