
胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式: ;
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是 ;
此时最好用含氢氧化铝的胃药(如胃舒平),写出其反应的离子方程式: 。
科目:高中化学 来源: 题型:填空题
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ,加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_______________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:
1MnO4—+Fe2++________===1Mn2++Fe3++________
(3)已知:
生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1 L 某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、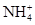 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、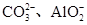 |

| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)写出亚硝酸的电离方程式: 。
(2)在酸性条件下,当NaNO2与KI按物质的量之比1∶1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为 (填化学式)。
(3)要得到稳定的HNO2溶液,可以向冷冻的NaNO2浓溶液中加入或通入某种物质,下列物质不适合的是 (填字母)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(4)碱性工业废水中的N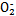 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
①写出上述反应的离子方程式: 。
②发生上述反应后废水的pH将 (填“增大”“减小”或“不变”)。
(5)酸性工业废水中的N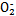 可用尿素除去。尿素
可用尿素除去。尿素
(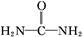 )与N
)与N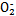 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①
(写出离子方程式);②Br2+3CO32—=BrO3—+ 5Br—+3CO2↑;③BrO3—+ 5Br—+6H+=3Br2+3H2O。其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,
然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:_ 。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式: ;
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;在下面的化学式上标出电子转移的方向和数目2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+ Na2SO4 + 2 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验: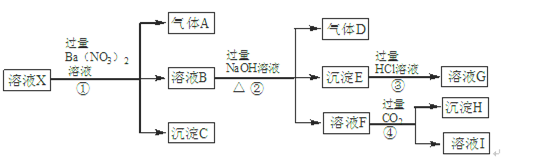
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是 ,不能确定是否含有的离子是 ,若要确定是否含有这种离子,最可靠方法是:
。
(2)溶液I中所含溶质有 (填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是 (填序号)。
(4)步骤①中生成气体A的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)1 000 mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
(1)写出生成白色沉淀B的离子方程式:___________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能与稀硝酸反应的成分是______________________________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com