
【题目】氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A. ①② B. ①③ C. ③④ D. ②④
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.有机物只能存在于动植物体内,不能通过人工的方法合成
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.烃是指燃烧后只生成CO2和H2O的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
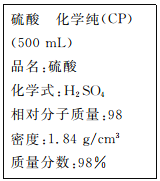
(1)该硫酸的物质的量浓度为____________mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240 ml,4.6 mol.L-l的稀硫酸,则在配制时需要取上述浓硫酸_____________mL。
(3)叙述将上述浓硫酸进行稀释的实验操作:____________________。
(4)在配制4.6 mol.L-l稀硫酸的过程中,下列情况对所配制的硫酸溶液的物质的量浓度有何影响?
①用量筒量取浓硫酸时俯视量筒刻度线_____________(填“偏高”、“偏低”或“无影响”,下同);
②未经冷却趁热将溶液注入容量瓶中:_____________;
③仰视容量瓶刻度线定容:__________________;
④移液时不慎将少量溶液滴在容量瓶外面:_____________;
(5)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水,液面离容量瓶颈刻度线下1~2 cm时,应_____________。
②加蒸馏水时不慎超过了容量瓶颈刻度线,应_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示: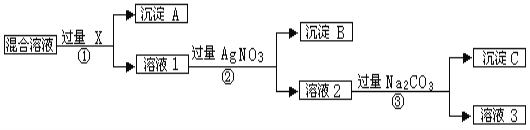
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X_____________,沉淀A____________,沉淀B______________;
(2)上述实验流程中加入过量的Na2CO3的目的是____________________________。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。


(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图2为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图2中氨气的体积分数为15%时,H2的转化率为 。
②图3中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(3)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:

①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4) = 。
②在相同实验条件下,若改为加入CH4 0.1mol,若要求平衡后H2在反应混合气中质量分数不变,则还需加入的物质及其物质的量为
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述已达平衡状态的是
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:

则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_________.
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H质量分数分别为w(C)=35.82%.w(H)=4.48%;②1 mol该酸与足量的NaHCO3反应放出44.8 L CO2,与足量的Na反应放出33.6 L H2(气体体积均已折算为标准状况);③该分子中存在三种化学环境不同的碳原子,氢原子也处于三种不同的化学环境。
通过计算回答下列问题:
(1)苹果酸的分子式 。含有的官能团名称为 。
(2)写出苹果酸的结构简式 。
(3)苹果酸的同分异构体中,符合②条件的有 种。
(4)苹果酸与蚁酸发生反应的方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡的是
A.密闭容器中二氧化碳的体积分数不变
B.密闭容器中混合气体的密度不变
C.密闭容器中气体的总物质的量不变
D.v(NH3)正=2v(CO2)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径。
(1)液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是 (填字母)。
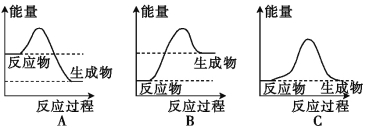
(2)“冰袋”可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:碳酸钠晶体与硝酸铵晶体的总能量 (填“高于”或“低于”)反应后生成产物的总能量。
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为 和 ;人们普遍使用的干电池工作时是将化学能转化为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com