
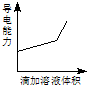
 浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )| A | B | C | D | |
| 溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
| 溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Cl2有酸性 | 用Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| B | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| C | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| D | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、CO2和NO2都是可形成酸雨的气体 |
| B、棉、麻和油脂都是高分子化合物 |
| C、氧化铝陶瓷和光导纤维都是无机非金属材料 |
| D、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、0.1mol?L-1NH4Cl和0.1mol?L-1NH3?H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D、常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| v(N2) |
| v(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 降低温度,平衡向正反应方向移动 |
B、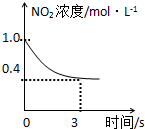 0-3s内,反应速率V (NO2)=0.2 mol?L-1 |
C、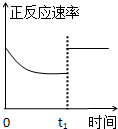 t1时仅加入催化剂,平衡正向移动 |
D、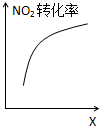 达到平衡时,仅改变X,则X为C(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅化学性质很稳定,因此硅在自然界中以游离态形式存在 |
| B、实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| C、实验室盛装NaOH溶液的试剂瓶要用橡皮塞而不用玻璃塞 |
| D、向待测液先滴加新制氯水再滴加KSCN溶液,溶液变成血红色,说明待测液中一定有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com