
����Ŀ���������һ��ǿ���������ڲ�ͬ������KClO3��KI����ΪI2��KIO3��ijʵ��С����ʵ�����ж�KClO3��KI�ķ�Ӧ������̽�����ش��������⣺
ʵ��һ����ȡ�����
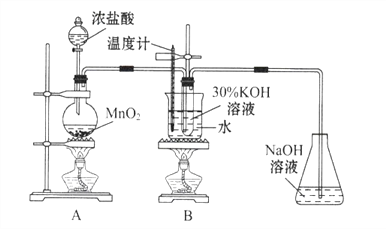
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ_______��ʵ�鿪ʼʱ�����Ƚ��е�ʵ�鲽����________��
��2����ȡʵ�������ȡ��B���Թ���ȴ�ᾧ�����ˣ�ϴ�ӣ���ʵ�����������Ҫ�IJ���������_______��
��3��A��Bװ��֮��ȱ�ٳ�ȥ�������Ȼ����װ�ã��Ƿ���ʵ������������Ӱ�죬��������_________����������������������ѡ����������˵�����ɣ���ѡ������������˵�����ɣ�
ʵ������������⻯�ط�Ӧ���о�
��4����С�������ϵ��ʵ���о���Ӧ�����Է�Ӧ�����Ӱ�죬����ϵ��aʵ��ļ�¼�����£�ʵ���������½��У���
�Թܱ�� | 1 | 2 | 3 | 4 |
0.20molL��1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3��s��/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL��1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
����ˮ/mL | 9.0 | 6.0 | 3.0 | 0 |
ʵ������ |
��ϵ��aʵ���ʵ��Ŀ����__��
�����1���Թ�ʵ���������__��
����2���Թ�ʵ����������Һ��Ϊ��ɫ��ȡ��������Һ���������Һ����ɫ��������������Ψһ����ԭ����ΪKCl
���𰸡�MnO2+4HCl��Ũ��![]() MnCl2+Cl2+H2O���װ���������ձ���©��������������ͷ�ιܣ����ͷ�ιܲ��۷֣��������л�����Ȼ������KOH��Ӧ����������صIJ����о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ������Ũ��Ϊ0�Ķ���ʵ��ClO3-+6I-+6H+= Cl-+3I2+3H2O
MnCl2+Cl2+H2O���װ���������ձ���©��������������ͷ�ιܣ����ͷ�ιܲ��۷֣��������л�����Ȼ������KOH��Ӧ����������صIJ����о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ������Ũ��Ϊ0�Ķ���ʵ��ClO3-+6I-+6H+= Cl-+3I2+3H2O
�����������⿼�鳣�����ʵ�ʵ������ȡ������������ʵļ��鼰��ͬ��Ӧ�����Բ����Ӱ����й�֪ʶ�㣬�������Ʊ���ԭ����ʵ��װ�á��������ռ����Ͳ�ͬ�ķ�Ӧ�������֣��������ʵ����ʡ���Һ������Լ��й�ʵ��������н��
��1��A����ȡCl2����ӦΪ MnO2+4HCl��Ũ��![]() MnCl2+Cl2+H2O ���й��������ȡʵ�飬�����ȼ��װ�õ������ԣ��𰸣����ȼ��װ�õ������ԡ�
MnCl2+Cl2+H2O ���й��������ȡʵ�飬�����ȼ��װ�õ������ԣ��𰸣����ȼ��װ�õ������ԡ�
��2�����ˣ�ϴ�Ӿ��壬��Ҫ�õ����������ձ���©����ϴ�ӵ�ʱ������ʹ�ý�ͷ�ιܣ���Ϊ�����������ձ���©������ͷ�ι�
��3���ӷ�����HCl����KOH��Ӧ����Cl2��Ӧ��KOH���٣�KClO3�������١��𰸣������Ӱ�죬ԭ�����Ȼ������KOH��Ӧ����������صIJ��� ��
��4���������ϱ��п�֪��4�������У�KClO3���������䣬KI�����ʵ������䣬��Һ����������䣬KI��Ũ�Ȳ��䣬����ĵ�����Ǹı�ģ���Ϻ������Ũ���DZ仯�ģ�Ψһ�ı��������ʵ���Ŀ���ǣ��о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ�� ��
��1���Թ���δ�����ᣬ������֧�Թܾ������ᣬĿ����̽�������Ƿ�Բ�����Ӱ�������һ���Ա�ʵ�飬��Ϊ�� ����Ũ��Ϊ0�Ķ���ʵ�顣
����Һ��Ϊ��ɫ�����������Һ����ɫ��֤��������I2���ʣ����ӷ���ʽΪClO3-+6I-+6H+= Cl-+3I2+3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҩƷ��ʹ�ú���������˵����ȷ����
A��R��ʾ�Ǵ���ҩ��OTC��ʾ����ҩ
B����Ƽ��ǹ��ʰ�ί���ϸ��ֹʹ�õ��˷ܼ�
C����Ʒ�����ж���ҩƷ
D���ҹ�����ҽѧ����ʱ��������ҽѧ�����ǡ���ũ���ݾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ճ������г��������ӵ�ʳ�������������������߸�ţ������������Ҷ�������������������ʣ�����ĵ⡢�����ơ�������Ӧ����Ϊ
A. Ԫ�� B. ���� C. ���� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС������ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�
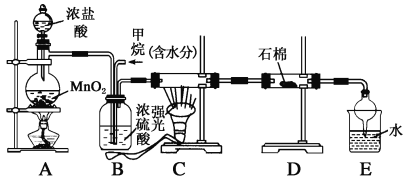
(1)Bװ�������ֹ��ܣ�
��__________����__________����__________��
(2)��V(Cl2)/V(CH4)��x��������������������Ȼ��⣬��xֵ��ȡֵ��ΧΪ__________��
(3)Dװ�õ�ʯ���о��Ȼ���KI��ĩ����������_____________��
(4)Eװ�õ�������__________��________(����)��
A���ռ����� B����������
C����ֹ���� D�������Ȼ���
(5)��Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС�����������û�����ɫС�����Ļ�ѧ����ʽΪ__________���ɼ��л���Ӧ�кܶั��Ӧ��
(6)Eװ�ó����������⣬�����л����E�з�����������ѷ���Ϊ________(����)��
A����ȡ�� B������
C�����˷� D����Һ��
��װ�û���ȱ�ݣ�ԭ����û�н���β����������β������Ҫ�ɷ���__________��________(����)��
A��CH4 B��CH3Cl
C��CH2Cl2 D��CHCl3
E��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1�����ڷ�Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g)�������Ӧ���ʦԣ�SO2��Ϊ0.05 mol��L-1��min-1����ԣ�O2����________________________����(SO3)=_______________________��
2SO3(g)�������Ӧ���ʦԣ�SO2��Ϊ0.05 mol��L-1��min-1����ԣ�O2����________________________����(SO3)=_______________________��
��2����֪��2SO2(g)��O2(g) ![]() 2SO3(g)����H����196.6 kJ��mol��1
2SO3(g)����H����196.6 kJ��mol��1
2NO(g)��O2(g) ![]() 2NO2(g)����H����113.0 kJ��mol��1
2NO2(g)����H����113.0 kJ��mol��1
��ӦNO2(g)��SO2(g) ![]() SO3(g)��NO(g)����H��______ kJ��mol��1��
SO3(g)��NO(g)����H��______ kJ��mol��1��
��3��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����______��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1 mol SO3��ͬʱ����1 mol NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��ͬѧΪ̽��ͬ���ڻ�ͬ����Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飺
��.��1�����������ļء��ơ�þ�����ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ���������������� �����ᷴӦ����ң� �����ᷴӦ���ɵ�������ࡣ
��2����Na2S��Һ��ͨ���������ֵ���ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ ��
��.������ͼװ������֤ͬ����Ԫ�طǽ����Եı仯���ɣ�
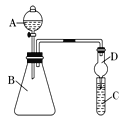
��1��Ҫ֤���ǽ����ԣ�Cl>I����A�м�Ũ���ᣬB�м�KMnO4(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ ��������֤���������D�������� ���ӻ��������ĽǶȿ��ǣ���װ����ȱ��β������װ�ã����� ��Һ����β����
��2��Ҫ֤���ǽ����ԣ�C>Si����A�м����ᣬB�м�CaCO3��C�м�Na2SiO3��Һ�����۲쵽C�� ��������ʦ��Ϊ������������֤������ǿ����ϵΪ̼����ᣬ���������������� �����Ӧ��B��D֮������һ��ʢ������ (ѡ��������ĸ��A��Ũ���� B��ŨNaOH��ҺC������Na2CO3��Һ D������NaHCO3��Һ)��ϴ��װ�á��Ľ���C�з�����Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�Ƕ�����Ԫ�أ����ڱ���A��B��B��C���ڣ�C��Eͬ���壻A��C����������֮��Ϊ2:3��B��������������C��������������1���� FԪ�ص�ԭ�������ڱ��а뾶��С������������D2C2��ˮ��Ӧ����C�ĵ��ʣ�����Һʹ��̪��Һ��졣
��1��F�����ֺ��ر�ʾ����Ϊ______��E������Ϊ______��D������������ˮ����ĵ���ʽ��______��
��2����B��C��D��E��Fԭ���γɵĵ������������Ӱ뾶��С����____�����Ӱ뾶������____���������ӷ��ţ�
��3��A��B��C���⻯���ȶ���˳��Ϊ_____���÷���ʽ��ʾ����B���⻯���B������������ˮ���ﷴӦ����Z,��Ӧ�ж��ѻ�ѧ����_____���γɵĻ�ѧ����________��������Ӽ����������Լ��������Ǽ��Լ��������������
��4��F2C��F2E�У��е�ϸߵ���__________���ѧʽ��������Ҫԭ����_________��
��5�����־���C��D��E��F����Ԫ�صĻ��������Ӧ�ų�����ķ�Ӧ���ӷ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڳ���Ԫ�ص���
A�� ͭ���� B�� п���� C�������� D�� �⡢��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com