
【题目】下列属于人体内常量元素的是
A. 铜、氟 B. 锌、硒 C.氮、氢 D. 碘、铁
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾
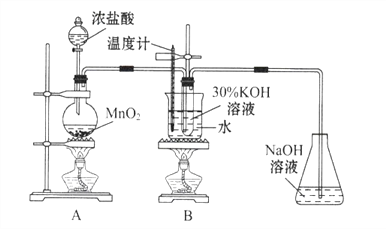
(1)A中反应的化学方程式为_______。实验开始时,首先进行的实验步骤是________。
(2)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有_______.
(3)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是_________(填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(4)该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是__.
②设计1号试管实验的作用是__.
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,是研究物质的性质的重要途径。某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
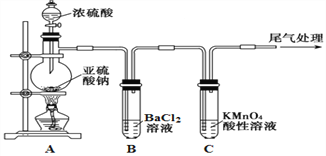
已知:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O,请回答下列问题:
Na2SO4+SO2↑+H2O,请回答下列问题:
(1) 装置A中盛放浓硫酸的仪器名称是__________________。
(2) 实验过程中,C中的现象是____________,说明SO2具有_________性。
(3) 实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验:
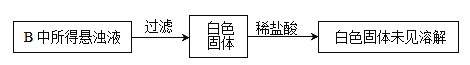
根据实验事实判断该白色沉淀的成分是_______________(填化学式),产生该白色沉淀的原因可能是_____________(填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并说明理由_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测得某溶液中仅含Cu2+、K+、SO42-、Cl-四种离子,且阳离子的个数比为Cu2+:K+=3:4,则SO42-和Cl-的个数比可能是
A.3:2
B.3:1
C.1:8
D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿佛加德罗常数的值,下列叙述不正确的是( )
A. 标准状况下,33.6L三氧化硫中含有硫原子的数目为1.5NA
B. 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)油脂是人体重要的能源物质,下列关于油脂的叙述正确的是( )
A. 油脂的主要成分是高级脂肪酸 B. 油脂属于天然有机高分子化合物
C. 煎炸食物的花生油比牛油的熔点低 D. 油脂可以在碱性条件下水解,用于制取肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);△H<0在850℃时,K=1.
CO2(g)+H2(g);△H<0在850℃时,K=1.
(1)若温度降低到950℃时,达到平衡时K______1(填“大于”“小于”或“等于”).
(2)850℃时,若向一容积可变的密闭容器中同时充入1molCO,3molH2O,1molCO2和xmolH2,则:
①当x=5.0时,上述平衡向______(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前全球范围内环境污染备受关注,化工生产中应大力倡导“绿色化学”和“原子经济”的理念,工业生产中的废物利用尤为重要。工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
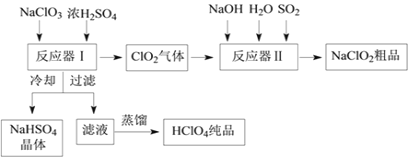
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。②高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为_______,冷却的目的是____________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是_________________________。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,请写出工业上用氯气和消石灰生产漂粉精的化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是 。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液至pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,若溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为 ,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为 ,通过计算确定上述方案 (填“可行”或“不可行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com