
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.
【答案】
(1)N2O4?2NO2;>
(2)0.14;0.003mol/L?s
(3)![]() ;0.54
;0.54
(4)A,B,D
【解析】解:(1)将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,反应的化学方程式为:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;依据化学平衡三段式列式计算分析判断;进行到40S和进行到60S时;
N2O4 | 2NO2 | ||
起始量(mol) | 0.4 | 0 | |
变化量(mol) | 0.2 | 0.4 | |
40S末(mol) | 0.2 | 0.4 |
得到b=0.2mol/L;
进行到60S和进行到60S时;
N2O4 | 2NO2 | ||
起始量(mol) | 0.4 | 0 | |
变化量(mol) | 0.22 | 0.44 | |
40S末(mol) | 0.18 | 0.44 |
c=0.18 mol/L
计算比较得到,b>c;
故答案为:N2O42NO2;>;
(2.)进行到20S;
N2O4 | 2NO2 | ||
起始量(mol) | 0.4 | 0 | |
变化量(mol) | 0.12 | 0.24 | |
20S末(mol) | 0.28 | 0.24 |
20s时,N2O4的浓度= ![]() =0.14mol/L;
=0.14mol/L;
0~20s内N2O4的平均反应速率= ![]() =0.003mol/Ls;
=0.003mol/Ls;
故答案为:0.14;0.003mol/Ls;
(3)N2O42NO2 , 平衡常数K= ![]() ;
;
80°C平衡状态和60S是相同平衡状态,平衡浓度c(NO2)=0.22mol/L,c(N2O4)=0.09mol/L;
平衡常数K= ![]() =
= ![]() =0.54mol/L;
=0.54mol/L;
故答案为: ![]() ;0.54;
;0.54;
(4)反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;该反应的K值越大,说明平衡正向进行,是温度降低的原因;
A、平衡正向进行N2O4的转化率越高,故A正确;
B、平衡正向进行NO2的产量越大,故B正确;
C、依据上述计算分析平衡正向进行,N2O4与NO2的浓度之比越小,故C错误;
D、该反应的K值越大,说明平衡正向进行,正反应进行的程度越大,故D正确;
故答案为:ABD.
(1)依据反应条件分析判断,结合化学平衡的三段式列式计算分析比较;(2)化学平衡的三段式列式计算,结合化学反应速率概念计算0~20s内N2O4的平均反应速率;(3)依据化学方程式和平衡常数概念写出平衡常数表达式,依据80°C平衡状态下结合三段式列式计算平衡浓度计算平衡常数.


科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:
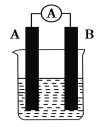
实验序号 | A | B | 烧杯中的液体 | 灵敏电流表指针是否偏转 |
1 | Zn | Zn | 乙醇 | 无 |
2 | Zn | Cu | 稀硫酸 | 有 |
3 | Zn | Cu | 稀硫酸 | 无 |
4 | Zn | Cu | 苯 | 无 |
5 | Cu | C | 氯化钠溶液 | 有 |
6 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述实验,回答下列问题:
(1)实验2中电流由________极流向________极(填“A”或“B”)。
(2)实验6中电子由B极流向A极,表明负极是________(填“镁”或“铝”)电极。
(3)实验5表明________(填字母序号,下同)。
A.铜在潮湿空气中不会被腐蚀
B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________。
A.金属活动顺序表中,活泼性强的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体这两种分散系的根本区别是( )
A. 是否有丁达尔现象 B. 分散质微粒直径的大小
C. 能否透过滤纸或半透膜 D. 是否均一、稳定、透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
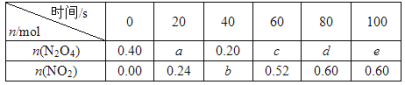
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
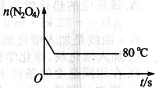
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.0×10﹣16 . 下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol?L﹣1的Cl﹣、I﹣的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ![]() ×10﹣11mol?L﹣1
×10﹣11mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个反应:
①Fe+H2SO4(稀)===FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
试回答下列问题:
(1)反应①中________(填元素符号)被氧化,还原产物为________;反应②中________作还原剂,________元素被还原。
(2)当反应①生成2 g H2时,消耗H2SO4的质量是________ g。
(3)反应②中生成32 g SO2气体时,消耗H2SO4的质量是________ g,其中有________ g H2SO4被还原,转移电子________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A.长期放置的苯酚晶体变红B.硝酸银晶体光照后变黑
C.氢氧化亚铁变灰绿再变红褐D.二氧化氮气体冷却后变淡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请配平下列化学方程式。
![]() _____________
_____________
(2)反应物中被氧化的元素_________,还原产物是________。
(3)反应中每生成标况下22.4L ![]() ,转移_______mol电子。
,转移_______mol电子。
(4)反应中氧化剂与还原剂物质的量之比____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com