
镁铝尖晶石(MgAl2O4)常做耐火材料。共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧。完成下列填空:
(1)为使Mg2+、Al3+同时生成沉淀,应该把 (填“a”或“b”)滴入另一溶液中。
(2)将上述制备反应中部分元素的简单离子:Al3+、Cl–、Mg2+、H+、O2–按半径由大到小的顺序排列
(用离子符号表示)。
(3)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是 ,属于难溶物的电离方程式 。
(4)不能说明氧元素的非金属性比氮元素强的事实是_________。
a. H2O比NH3稳定 b. 共用电子对偏向:H-O>H-N
c. 沸点:H2O>NH3 d. NO中氮是+2价,氧是-2价
(1)a(1分)
(2)Cl->O2->Mg2+>Al3+>H+
(3)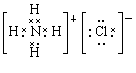 (1分) H++AlO2–+H2O
(1分) H++AlO2–+H2O Al(OH)3
Al(OH)3 Al3++3OH–(2分)
Al3++3OH–(2分)
(4)c(2分)
解析试题分析:(1)为使Mg2+、Al3+同时生成沉淀,应该把AlCl3和MgCl2的混合溶液滴入到过量的氨水中,因此正确的答案选a。
(2)根据微粒电子层越多,半径越大.。在核外电子排布相同的条件下,核电荷数越多,微粒半径越小,据此可知离子的半径大小顺序是Cl->O2->Mg2+>Al3+>H+。
(3)AlCl3与氨水反应生成氢氧化铝沉淀和氯化铵,氯化铵是离子化合物,电子式为 。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O
。氢氧化铝是两性氢氧化物,其电离方程式为H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。
Al3++3OH-。
(4)a.非金属性越强,氢化物的稳定性越强,所以根据H2O比NH3稳定,可以证明氧元素的非金属性比氮元素强,故a错误;b.共用电子对偏向:H-O>H-N,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故b错误;c.沸点:H2O>NH3是物理性质的表现,但是氧元素的非金属性比氮元素强是化学性质的表现,故C正确;d.NO中氮是+2价,氧是-2价,证明氧原子的得电子能力强于氮原子,即氧元素的非金属性比氮元素强,故d错误,答案选c。
考点:考查氢氧化镁、氢氧化铝的生成;氢氧化铝的性质;电子式以及非金属性强弱比较等


科目:高中化学 来源: 题型:填空题
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为 .
(2)转化②的化学方程式为 .转化③的离子方程式为 .
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择 (填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。
请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属单质A与盐酸反应生成浅绿色溶液B,同时放出气体C。如果在B溶液中通入氯气,则B转变成棕黄色溶液D,将溶液D分为两份,一份加入几滴KSCN溶液,溶液变成血红色,另一份加入A,则棕黄色溶液D重新变成浅绿色溶液B。则:
(1)各物质的化学式分别是:A________ ,B________ ,C________ ,D________;
(2)有关反应的离子方程式有:
① B→D___________________________;
② D→B____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C~D过程中的离子方程式 ;
(2)n(Mg2+)/ n(Al3+) = ;
(3)C1/C2= ;
(4)所加入NaOH溶液的体积a= mL。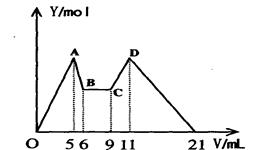
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将1.000gFeC2O4·2H20固体样品放在热重分析仪中进行热重分析,測得其热重分析曲线(样品质量随温度变化的曲线)如下图所示: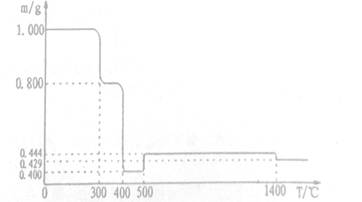
已知:①草酸盐受热分解易放出碳的氧化物。②5000C之前,该热重分析仪的样品池处于Ar气气氛中,5000C时起,样品池与大气相通。完成下列填空:
(1)3000C时是样品脱水的过程,试确定3500C时样品是否脱水完全_____ (填“是"或否“),判断的理由是____(要求写出推算过程)。
(2 ) 4000C时发生变化的化学方程式是_______。
(3) 将6000C时样品池中残留的固体隔绝空气冷却至室温,再向该固体中加入一定量的稀盐酸刚好完全溶解,用pH试纸测得所得溶液的PH=3,其原因是____(用离子方程式回答):向该溶液中滴加适量NaOH溶液生成红褐色沉淀,測得此时溶液中铁元索的离子浓度为4.0x10-11mol/L,则此时溶液的pH=_______(已知:Ksp[Fe(OH)2]=8.0×10-16,Ksp[Fe(OH)3]=4.0×10-38)
(4) 将15000C时样品池中残留的固体隔绝空气冷却后,用稀盐酸溶解得一棕黄色溶液。取少量该溶液滴加KSCN,溶液显红色;另取少量该溶液滴加K3[Fe(CN)6)(铁氰化钾)溶液,产生特征蓝色沉淀。试写出图中14000C时发生反应的化学方程式_________ ,产生特征蓝色沉淀的离子反应方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=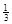 Na3AlH6 (s)+
Na3AlH6 (s)+ 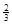 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) + 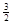 H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) +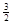 H2(g) ΔH= 。
H2(g) ΔH= 。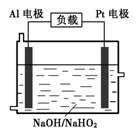
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
| 铵盐的质量/g | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量/g | m | m | 1.29 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com