
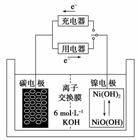
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确的是( )
A.放电时K+移向负极
B.放电时电池负极的电极反应为H2-2e-===2H+
C.放电时电池正极的电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
D.该电池充电时将碳电极与电源的正极相连
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
在体积固定的密闭容器中N2 与H2发生反应:N2(g)+3H2(g)  2NH3(g) ,
2NH3(g) ,
达到平衡时c (N2)=3.5 mol·L-1 ,c (H2)=1 mol·L-1 ,c (NH3)=5 mol·L-1 ,求:
(1)N2和H2的起始浓度(4分)
(2)N2的转化率(2分)(要求有解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:从下表格中判断下列说法正确的是
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.在冰醋酸和水中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钾、硫酸铝和硫酸的混合溶液中,其pH=1,c(Al3+)=0.3mol·L-1,c(SO42—)=0.6mol·L-1
则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某一密闭绝热容器中盛有饱和Ca(OH)2溶液,加入少量CaO粉末,下列说法正确的是( )
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)·c(OH-)的乘积不变
⑤c(H+)一定增大
A.① B.①⑤ C.①②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
新华社2009年10月15日报道:全国农村应当在“绿色生态—美丽多彩—低碳节能—循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25 ℃,101 kPa时:C(s)+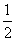 O2(g)===CO(g) ΔH=-126.4 kJ·mol-1
O2(g)===CO(g) ΔH=-126.4 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则在25 ℃、101 kPa时:C(s)+H2O(g)===CO(g)+H2(g) ΔH=______________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态?________(填“是”或“否”),其判断依据是______ 。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
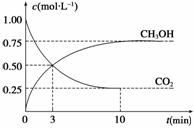
①从反应开始到平衡,氢气的平均反应速率v(H2)= ;
②下列措施能使 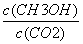 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,既能与强酸反应,又能与强碱反应的是
①NaHCO3 ②Al ③Al2O3 ④Al(OH)3
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,
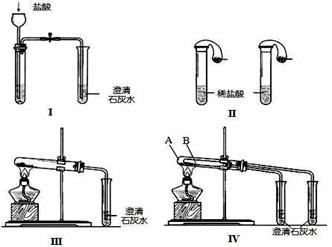 如图Ⅰ~Ⅳ所示。
如图Ⅰ~Ⅳ所示。
(1)只根据图I、II所示实验,能够达到实验目的是(填装置序号) ;
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为 ;
与实验III相比,实验IV的优点是(填选项序号) ;
A.IV比III复杂 B.IV比III安全
C.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是 ;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当石灰水过量时,其离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。
Ⅰ 取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。
(1)搅拌的目的是 。
(2)取少量滤液于试管中,向其中滴加几滴0.1 mol·L-1KI溶液,观察到的现象是 ,溶液中c(Pb2+) (填“增大”、“减小”或“不变”)。
Ⅱ 准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH + Pb2+= R2Pb + 2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5 mol。
(3)在此实验温度下,PbI2的溶度积常数Ksp= 。
(4)若步骤Ⅰ盛装滤液的烧杯中有少量水,Ksp测定结果将会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com