
【题目】下列有关金属材料的说法不正确的是( )
A.青铜、不锈钢、氧化铁都属于合金
B.合金的很多性能与组成它们的纯金属不同
C.铁在潮湿的空气中比在干燥的空气中更易生锈
D.铸造硬币的金属材料一般具有耐腐蚀、易铸造的性质
科目:高中化学 来源: 题型:
【题目】塑化剂是一种对人体有害的物质。增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得:

下列说法正确的是
A. DCHP的分子式为C20H24O4
B. 环己醇分子的核磁共振氢谱有4个吸收峰
C. DCHP能发生加成反应和取代反应,不能发生酯化反应
D. 1mol DCHP可与4mol NaOH完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是( )
A. 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)=Fe(OH)3↓+3H+
B. 将1 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
C. 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯气体。
(1)请完成该过程的化学方程式并配平。______KClO3+_____HCl(浓) =____ KCl+_____ClO2↑+____Cl2↑+____H2O。
(2)浓盐酸在反应中显示出来的性质是 ________(填写编号)。
①氧化性 ②还原性 ③酸性 ④碱性
(3)若反应生成0.1 mol Cl2,则转移的电子数为________。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1kg ClO2相当于________kg Cl2。(提示:Cl2和ClO2在消毒过程中均变为Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
B | B原子基态时s电子与p电子数目相同 |
C | C在组成化合物时没有正价 |
D | 常温常压下,D单质是淡黄色固体,常在火山口附近沉积 |
E | E和D同周期,E的电负性大于D |
F | F原子基态时未成对电子数是同周期中最多的 |
G | G的一种核素的质量数为63,中子数为34 |
(1)AB32-的立体构型为________,其中A的杂化轨道类型是_________________________;
(2)A22-与B22+互为等电子体,则B22+的电子式可表示为______________,1molB22+中含有共用电子对的数目为_____________;
(3)AD2是一种常用的溶剂,AD2的分子中存在___个π键。表中C、D、E三种元素分别与氢形成的共价键中,键长最大的是________(用具体元素符号组成的化学键表示)。
(4)下列有关A2H2的说法正确的是_____。
A.分子中所有原子都满足8电子稳定结构 B.每个分子中σ键和π键数目之比为2:3
C.它是由极性键和非极性键构成的分子 D.分子的空间构型为直线形
(5)写出G元素的原子核外电子排布式___________;工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式_____________________________;若往含有G2+的溶液中加过量氢氧化钠溶液,可生成Na2[G(OH)4]溶液,Na2[G(OH)4]具有的化学键类型有________。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(6)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe 均为第 4 周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJmol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 4048 | 2957 | |
F元素为_____(填写元素名称);请写出基态 Mn2+的价电子轨道排布图____________________,比较两元素的 I2、 I3可知,气态 Mn2+再失去 1个电子比气态 Fe2+再失去 1个电子难,请解释原因__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
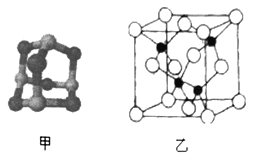
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于镁、铝的叙述中不正确的是( )
A、铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气
B、镁铝合金的强度和硬度都比纯铝和纯镁大
C、在高温下,可以用铝制的容器装运浓硫酸或浓硝酸
D、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而失去光泽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com