
【题目】第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
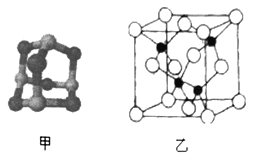
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
【答案】 4s24p2 > NH3分子间存在氢键 As4O6 sp3 H2SeO4的非羟基氧原子数多于H2SeO3中的非羟基氧原子数 (CH3)3Ga+AsH3![]() GaAs+3CH4
GaAs+3CH4 ![]()
【解析】分析: (1)锗为32号元素,根据能量最低原理书写电子排布式;(2)根据分子间能形成氢键的沸点高判断;(3)根据图中原子形成的共价键数判断属于哪种元素,再根据原子数写化学式;根据![]() 键电子对数和对孤电子对数判断As的杂化方式;(4)根据分子中化合价对电子偏向的影响分析;(5)已知反应物和部分生成物根据原子守恒书写;先求出一个晶胞中砷元素的质量,再根据晶胞的体积求算。
键电子对数和对孤电子对数判断As的杂化方式;(4)根据分子中化合价对电子偏向的影响分析;(5)已知反应物和部分生成物根据原子守恒书写;先求出一个晶胞中砷元素的质量,再根据晶胞的体积求算。
详解:(1)锗为32号元素,原子核外有32个电子,其核外价电子电子排布式为4s24p2;
因此,本题正确答案是: 4s24p2;
(2)N原子的非金属性较强,NH3分子间能形成氢键沸点高,所以NH3的沸点大于AsH3的沸点;因此,本题正确答案是: > ;NH3分子间存在氢键;
(3)氧原子能形成2个共价键,As形成3个共价键,由图可以知道分子中O原子数为6,As原子数为4,所以其化学式为As4O6;As最外层有5个电子,形成3个共价键即![]() 键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;因此,本题正确答案是: As4O6 ;sp3;
键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;因此,本题正确答案是: As4O6 ;sp3;
(4) H2SeO4和H2SeO3可表示为(HO)2SeO2和(HO)3Se, H2SeO4的非羟基氧原子数多于H2SeO3中的非羟基氧原子数,更易电离出H+,所以H2SeO4比H2SeO3酸性强;因此,本题正确答案是: H2SeO4的非羟基氧原子数多于H2SeO3中的非羟基氧原子数。
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为: (CH3)3Ga+AsH3![]() GaAs+3CH4;由砷化镓的晶胞结构图可以知道一个晶胞中含有4个As原子,一个晶胞中砷元素的质量为
GaAs+3CH4;由砷化镓的晶胞结构图可以知道一个晶胞中含有4个As原子,一个晶胞中砷元素的质量为![]() g=
g=![]() g,晶胞的体积为
g,晶胞的体积为![]() ,则每立方厘米该晶体中所含砷元素的质量为
,则每立方厘米该晶体中所含砷元素的质量为 =
=![]() g ,因此,本题正确答案是: (CH3)3Ga+AsH3
g ,因此,本题正确答案是: (CH3)3Ga+AsH3![]() GaAs+3CH4;
GaAs+3CH4;![]() g。
g。


科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)图中X是________,I在小麦种子中主要是指______________。
(2)图中Z是________,使用甲基绿、派洛宁(吡罗红)混合染液染色,可使Ⅲ呈现________色。
(3)图中P的结构通式为________;写出由P形成Ⅳ的结构层次______________。
(4)Ⅲ和Ⅳ两者都有多样性,两者多样性的关系是前者________后者。
(5)构成细胞的化合物中,随着年龄增长明显减少的主要是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属材料的说法不正确的是( )
A.青铜、不锈钢、氧化铁都属于合金
B.合金的很多性能与组成它们的纯金属不同
C.铁在潮湿的空气中比在干燥的空气中更易生锈
D.铸造硬币的金属材料一般具有耐腐蚀、易铸造的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A. 该有机物的分子式为C7H7O3
B. 该有机物能发生取代、加成和氧化反应
C. 1mol该有机物最多能与2mol H2发生加成反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO32-、NO3-等微粒它们的价电子总数都是________,因此它们与由ⅥA族两元素组成的________分子的结构相同,呈________形,CO32-中心原子的价层电子对数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 是化学中常见的物质。常温下,E 是一种无色无味的液体,它们之间有如下反应关系。

(1)若 A 是一种具有磁性的黑色金属氧化物,B 是一种常见的非氧化性酸,A 和 B 反应的离子方程式为________;若在生成物 C 中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式________________________________。A 与 CO 高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式________________________________。
(2)若实验室中利用固体 A 和 B 的反应制备气体 C,C 是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________________________;实验室检验 C 的方法为________________________________。
(3)若 B 是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为
________________________________。若用湿润的淀粉碘化钾试纸靠近盛满 B 的试管口,看到的现象为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com