
【题目】同温同压下,若2体积单质气体A2和1体积单质气体B2化合生成2体积气体C,则C的化学式为( )
A.A2BB.ABC.AB2D.A2B
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是( )
A. 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)=Fe(OH)3↓+3H+
B. 将1 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
C. 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
B | B原子基态时s电子与p电子数目相同 |
C | C在组成化合物时没有正价 |
D | 常温常压下,D单质是淡黄色固体,常在火山口附近沉积 |
E | E和D同周期,E的电负性大于D |
F | F原子基态时未成对电子数是同周期中最多的 |
G | G的一种核素的质量数为63,中子数为34 |
(1)AB32-的立体构型为________,其中A的杂化轨道类型是_________________________;
(2)A22-与B22+互为等电子体,则B22+的电子式可表示为______________,1molB22+中含有共用电子对的数目为_____________;
(3)AD2是一种常用的溶剂,AD2的分子中存在___个π键。表中C、D、E三种元素分别与氢形成的共价键中,键长最大的是________(用具体元素符号组成的化学键表示)。
(4)下列有关A2H2的说法正确的是_____。
A.分子中所有原子都满足8电子稳定结构 B.每个分子中σ键和π键数目之比为2:3
C.它是由极性键和非极性键构成的分子 D.分子的空间构型为直线形
(5)写出G元素的原子核外电子排布式___________;工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式_____________________________;若往含有G2+的溶液中加过量氢氧化钠溶液,可生成Na2[G(OH)4]溶液,Na2[G(OH)4]具有的化学键类型有________。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(6)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe 均为第 4 周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJmol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 4048 | 2957 | |
F元素为_____(填写元素名称);请写出基态 Mn2+的价电子轨道排布图____________________,比较两元素的 I2、 I3可知,气态 Mn2+再失去 1个电子比气态 Fe2+再失去 1个电子难,请解释原因__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
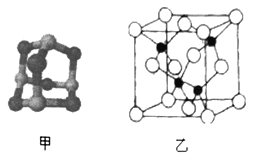
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下物质: ①NaHSO4晶体②SO3③液态硫酸 ④铁⑤BaSO4固体⑥饱和FeCl3溶液⑦酒精(C2H5OH)⑧熔融的K2SO4,其中能导电的是__________,属于电解质的是__________,属于非电解质的是__________
(2)下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________
(3)化学反应FeS+H2SO4(浓)![]() Fe2(SO4)3+SO2↑ +S↓ +H2O(未配平)中:氧化产物是:__________, 还原产物是:__________
Fe2(SO4)3+SO2↑ +S↓ +H2O(未配平)中:氧化产物是:__________, 还原产物是:__________
(4)请写出醋酸(CH3COOH)与氢氧化钠溶液反应的离子方程式_______
(5)盐酸可以除铁锈,请写出发生反应的离子方程式:__________
(6)工业上常用H2O2在酸性条件下氧化污水中的Fe2+,请写出离子方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2L 由 NaCl、MgCl2、CaCl2 组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是

A. 3.0molB. 2.0molC. 1.0molD. 0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列说法不正确的是( )
A. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
B. 二氧化碳气体能造成温室效应
C. 漂白粉中的有效成分是次氯酸钙
D. 晶体硅是制取光导纤维的主要材料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于镁、铝的叙述中不正确的是( )
A、铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气
B、镁铝合金的强度和硬度都比纯铝和纯镁大
C、在高温下,可以用铝制的容器装运浓硫酸或浓硝酸
D、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而失去光泽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com