
| A、⑥>④>③>①=⑤>② |
| B、①=②>③>⑥>④>⑤ |
| C、②>①>③>④>⑥>⑤ |
| D、④>⑥>③>①=⑤>② |


科目:高中化学 来源: 题型:
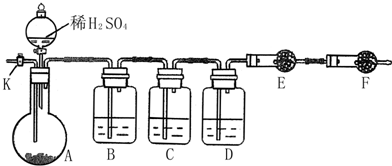 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热时间太短 |
| B、加AgNO3溶液前未用稀HNO3酸化 |
| C、应该和NaOH的乙醇溶液共热 |
| D、不应该冷却后再滴入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸银 | B、单质碘 |
| C、溴化银 | D、硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若c1=c2,则醋酸溶液中的c(H+)与氢氧化钠溶液中的c(OH-)相同 |
| B、若醋酸溶液的pH=3,氢氧化钠溶液的pH=11,则醋酸溶液中的c(CH3COO-)与氢氧化钠钠溶液中的c(Na+)相同 |
| C、将醋酸溶液与氢氧化钠溶液混合,若c1=c2,则所得溶液的pH=7 |
| D、将醋酸溶液与氢氧化钠溶液混合,若所得混合溶液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
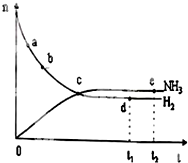 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的逆反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
| D、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com