
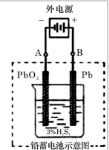
| 放电 |
| 充电 |
| 放电 |
| 充电 |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 |
| B、金属钠着火燃烧时,用q灭火 |
| C、铝比铁活泼,所以铝比铁更容易被腐蚀 |
| D、正常雨水PH等于7,酸雨的PH小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑥>④>③>①=⑤>② |
| B、①=②>③>⑥>④>⑤ |
| C、②>①>③>④>⑥>⑤ |
| D、④>⑥>③>①=⑤>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在使用过程中,电池负极区溶液pH增大 |
| B、在使用过程中,电流由Ag2O极经外电路流向Zn极 |
| C、在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| D、外电路中每通过0.2mol电子,正极的质量理论上减小33.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水淡化 |
| B、分离豆浆和豆渣 |
| C、用海水晒盐 |
| D、从碘水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 1 |
| 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
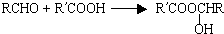 ,又知醇和氨都有似水性(与水的性质相似),酯可以水解又可以醇解或者氨解.现以乙烯为原料合成维纶,其主要步骤如下:
,又知醇和氨都有似水性(与水的性质相似),酯可以水解又可以醇解或者氨解.现以乙烯为原料合成维纶,其主要步骤如下: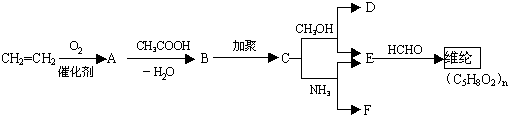
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2,3-二甲基-3,3-二乙基戊烷 |
| B、2,3-二甲基丁烷 |
| C、2,2-二甲基-1-丁醇 |
| D、1,3-二甲基-1-丁醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com