在TK、300MPa时,往容积可变的密闭容器中充入 1molN
2、3molH
2,此时,容器的体积为200L.向容器中加入催化剂(铁触媒)并保持恒温恒压,发生反应:N
2 (g)+3H
2(g)?2NH
3(g),达到平衡时 NH
3的体积分数为
.
试回答下列问题:
(1)保持上述温度和压强不变,若向容器中只充入2molNH
3,并加入铁触媒催化剂.则平衡时,N
2的体积分数是
,容器的体积为
.
(2)保持上述温度不变,在200L的定容容器中进行合成氨反应,改变起始时原料气的充入量,一段时间后,测得N
2、H
2、NH
3的物质的量分别为2mol、1mol、2mol,则此时反应N
2(g)+3H
2(g)?2NH
3(g) V(N
2)
正
3V(H
2)
逆(填:“>”、“<”、“=”、“不能确定”)
(3)温度仍保持TK,容器体积保持200L不变(恒容).充入
amolN
2,
bmolH
2,并加入铁触媒催化剂,反应达到平衡时,NH
3的体积分数仍为
,体系压强为300MPa.若
a:
b=1:3,则a=
mol.
(4)在三个相同容器中各充入1 molN
2和3molH
2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图.下列说法正确的是
(填序号).

A.图Ⅰ可能是不同催化剂对反应的影响,且催化剂性能 2>1
B.图Ⅱ可能是同温同压下,不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅱ可能是不同压强对反应的影响,且P
1>P
2 D.图Ⅲ可能是不同温度对反应的影响,且T
1>T
2




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )
25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )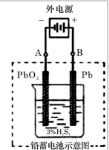
 ,lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
,lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )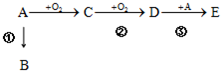
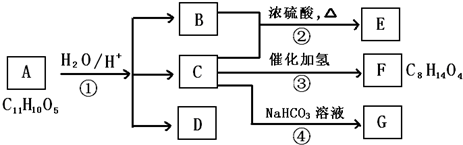
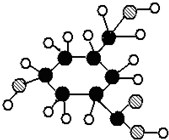
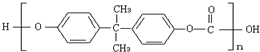 2010年5月1日上海世博会隆重开幕,受到全世界人们的关注.世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )
2010年5月1日上海世博会隆重开幕,受到全世界人们的关注.世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )