
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
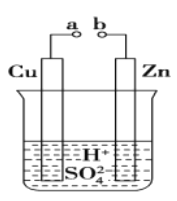
(1)a和b用导线连接,Zn极为原电池__________极(填“正”或“负”),Cu极发生__________(填“氧化”或“还原”),溶液中SO42-移向_________(填“Cu”或“Zn”)极
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.4mol电子,则理论上Zn片应溶解__________g
(3)有同学想把Ba(OH)2·8H2O晶体与NH4NO3晶体的反应设计成原电池,你认为是否可行?__________(填“是”或“否”),理由是 __________
【答案】 负 还原 Zn 13 否 该反应不属于氧化还原反应
【解析】(1)a和b用导线连接,该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为Zn-2e-=Zn2+、正极反应为2H++2e-=H2↑;
(2)根据锌和转移电子之间的关系式计算;
(3)原电池反应必须是自发进行的放热的氧化还原反应;据此分析解答。
(1)a和b用导线连接,该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子发生还原反应,电极反应为2H++2e-=H2↑,锌失电子发生氧化反应,电极反应为Zn-2e-=Zn2+;电解质溶液中氢离子向正极Cu极移动,故答案为:负;还原; Zn;
(2)根据锌和转移电子之间的关系式Zn-2e-=Zn2+得,消耗锌的质量=![]() =0.2mol,其质量为0.2mol×65g/mol=13g,故答案为:13;
=0.2mol,其质量为0.2mol×65g/mol=13g,故答案为:13;
(3)原电池反应必须是自发进行的放热的氧化还原反应,该反应是吸热反应且不是氧化还原反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应。


科目:高中化学 来源: 题型:
【题目】下列物质的变化,能通过一步化学反应完成的是( )
A.Al→Al(OH)3B.Fe→FeCl2C.SiO2→Na2SiO3D.SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是 ( )
A. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B. 用铜作电极电解稀硫酸,反应Cu+H2SO4 ![]() CuSO4+H2↑可以发生
CuSO4+H2↑可以发生
C. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D. 使用催化剂,可加快反应速率,改变反应限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
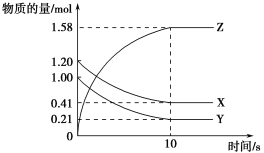
(1)从反应开始到10 s,用Z表示的反应速率为____________。X的物质的量浓度减少了___________________,Y的转化率为_____________________。
(2)该反应的化学方程式为:_________________________________。
(3)若要使反应时间缩短,可使用下列哪些方法_____________。
A.升高温度
B.增大容器的体积
C.通入He气增大容器的压强
D.加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 丙烷和丁烷互称为同系物
B. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C. 沸点:正丁烷>异丁烷>丙烷
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
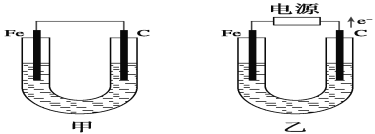
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_______________________________。
②甲池中碳极上电极反应式是____________________________,乙池碳极上电极反应属于______________(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为________________________________________。
④若乙池转移0.02 mol e-后停止实验,池中电解质溶液体积是200 mL,则溶液混合均匀后的c(OH—)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH3、HCl极易溶于水,Cl2能溶于水。下列各装置不能达到实验目的是
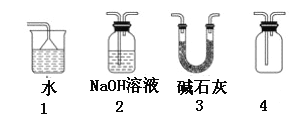
A. 利用1吸收多余的氨气
B. 装置2可用于除去CO2中的HCl
C. 装置3可用于干燥氨气
D. 装置4可用于排空气法收集H2、CO2、Cl2、HCl等气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com