
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1. 77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________,溶液中![]() ___________。
___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
【答案】 < abc HCOOH(aq)![]() HCOO-(aq)+H+(aq) △H=(-a+b)kJ/mol CN-+CO2+H2O=HCN+HCO3- HCOO-+H2O
HCOO-(aq)+H+(aq) △H=(-a+b)kJ/mol CN-+CO2+H2O=HCN+HCO3- HCOO-+H2O![]() HCOOH+OH- l.77×105 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2 c(H+)-2c(OH-) 10-6 5.2×10-5 23.6
HCOOH+OH- l.77×105 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2 c(H+)-2c(OH-) 10-6 5.2×10-5 23.6
【解析】试题分析:本题考查电离平衡常数的应用,盐类水解的规律,弱酸电离热化学方程式的书写,水解离子方程式的书写,溶液中水电离的c(H+)的计算,溶液中粒子浓度的大小比较,溶度积的计算。
(1)①由于Ka(HCN)![]() Ka1(H2CO3),根据“越弱越水解”,0.1mol/LNaCN溶液中CN-的水解能力大于0.1mol/LNaHCO3溶液中HCO3-的水解能力,则c(CN-)
Ka1(H2CO3),根据“越弱越水解”,0.1mol/LNaCN溶液中CN-的水解能力大于0.1mol/LNaHCO3溶液中HCO3-的水解能力,则c(CN-)![]() c(HCO3-)。
c(HCO3-)。
②由于Ka(HCOOH)![]() Ka(HCN)
Ka(HCN)![]() Ka2(H2CO3),根据“越弱越水解”,等物质的量浓度的HCOONa、NaCN、Na2CO3溶液水解能力HCOO-
Ka2(H2CO3),根据“越弱越水解”,等物质的量浓度的HCOONa、NaCN、Na2CO3溶液水解能力HCOO-![]() CN-
CN-![]() CO32-,溶液pH由大到小的顺序为:Na2CO3
CO32-,溶液pH由大到小的顺序为:Na2CO3![]() NaCN
NaCN![]() HCOONa;pH相同的三种溶液物质的量浓度由大到小的顺序为:HCOONa
HCOONa;pH相同的三种溶液物质的量浓度由大到小的顺序为:HCOONa![]() NaCN
NaCN![]() Na2CO3,即a
Na2CO3,即a![]() b
b![]() c。
c。
③ 将两式编号,
HCOOH(aq)+OH -(aq)=HCOO-(aq)+H2O(l)ΔH=-a kJ/mol(①式)
H+(aq)+OH-(aq)=H2O(l)ΔH=-b kJ/mol(②式)
应用盖斯定律,①式-②式得,HCOOH(aq)![]() HCOO-
HCOO-
④由于Ka1(H2CO3)![]() Ka(HCN)
Ka(HCN)![]() Ka2(H2CO3),根据“强酸制弱酸”的复分解反应规律,将少量CO2通入NaCN溶液中生成HCN和NaHCO3,反应的化学方程式为CO2+H2O+NaCN=NaHCO3+HCN,离子方程式为CO2+H2O+CN-=HCN+HCO3-。
Ka2(H2CO3),根据“强酸制弱酸”的复分解反应规律,将少量CO2通入NaCN溶液中生成HCN和NaHCO3,反应的化学方程式为CO2+H2O+NaCN=NaHCO3+HCN,离子方程式为CO2+H2O+CN-=HCN+HCO3-。
⑤室温下一定浓度的HCOONa溶液pH=9,溶液呈碱性说明HCOO-发生水解,HCOO-水解的离子方程式为HCOO-+H2O![]() HCOOH+OH-。该水解反应的水解平衡常数=
HCOOH+OH-。该水解反应的水解平衡常数=![]() =
=![]() =
=![]() =
=![]() =5.65
=5.65![]() 10-11,pH=9即c(H+)=1
10-11,pH=9即c(H+)=1![]() 10-9mol/L,c(OH-)=1
10-9mol/L,c(OH-)=1![]() 10-5mol/L,
10-5mol/L,![]()
![]() 1
1![]() 10-5=5.65
10-5=5.65![]() 10-11,
10-11,![]() =5.65
=5.65![]() 10-6,则
10-6,则![]() =1.77
=1.77![]() 105。
105。
(2)①d点加入20mL盐酸溶液,盐酸与氨水恰好完全反应得到NH4Cl溶液,NH4Cl溶液中由于NH4+的水解溶液呈酸性,d点所示溶液中离子浓度由大到小的顺序为c(Cl-)![]() c(NH4+)
c(NH4+)![]() c(H+)
c(H+)![]() c(OH-)。
c(OH-)。
②b点加入10mL盐酸溶液,盐酸与氨水反应后得到等物质的量浓度的NH4Cl和NH3·H2O的混合液,溶液中的电荷守恒为c(H+)+c(NH4+)=c(OH-)+c(Cl-),溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=2c(Cl-),两式整理得,c(NH3·H2O)-c(NH4+)=2c(H+)-2c(OH-)。
③pH=10的氨水溶液中H+全部来自水电离,c(H+)水=c(H+)溶液=1![]() 10-10mol/L;pH=4的NH4Cl溶液中H+与OH-全部来自水电离,水电离的OH-部分与NH4+结合成NH3·H2O,c(H+)水=c(H+)溶液=1
10-10mol/L;pH=4的NH4Cl溶液中H+与OH-全部来自水电离,水电离的OH-部分与NH4+结合成NH3·H2O,c(H+)水=c(H+)溶液=1![]() 10-4mol/L;pH=10的氨水溶液与pH=4的NH4Cl溶液中水电离的c(H+)之比为(1
10-4mol/L;pH=10的氨水溶液与pH=4的NH4Cl溶液中水电离的c(H+)之比为(1![]() 10-10mol/L):(1
10-10mol/L):(1![]() 10-4mol/L)=10-6。
10-4mol/L)=10-6。
(3)①将Na2CO3溶液与BaCl2等体积混合后,c(CO32-)=1![]() 10-4mol/L,c(Ba2+)=1/2c(Ba2+)原溶液,要形成沉淀c(Ba2+)·c(CO32-)=Ksp(BaCO3)=2.6
10-4mol/L,c(Ba2+)=1/2c(Ba2+)原溶液,要形成沉淀c(Ba2+)·c(CO32-)=Ksp(BaCO3)=2.6![]() 10-9,c(Ba2+)=2.6
10-9,c(Ba2+)=2.6![]() 10-9
10-9![]() (1
(1![]() 10-4)=2.6
10-4)=2.6![]() 10-5mol/L,所需BaCl2溶液的最小浓度为5.2
10-5mol/L,所需BaCl2溶液的最小浓度为5.2![]() 10-5mol/L。
10-5mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =
=![]() =
=![]() =
=![]() =23.6。
=23.6。


科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。
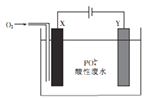
下列说法正确的是
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++02-4H++4P043-=4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组比值为1∶2的是( )
A. 0.1mol/L与0.2mol/L醋酸溶液,c(H+)之比
B. 0.lmol/LNa2CO3溶液,c(CO32-)与c(Na+)之比
C. pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D. pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:
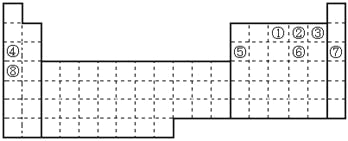
(1)画出⑥的离子结构示意图__________。
(2)在②、③、④、⑤四种元素中,其简单离子半径按由大到小的排列顺序为______(示例:用r(A2-)>r(B-)的形式表示)。
(3)元素②、③氢化物的稳定性由强到弱的顺序为________(填化学式)。
(4)与③同一主族并且在短周期的元素的某种含氧酸可以消毒杀菌,写出该物质的电子式___________________________。
(5)表中能形成两性氢氧化物的元素是_______(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式____________________________。
(6)比较①与其同族短周期元素的氢化物的熔沸点高低,并说明理由_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图l所示:

①在0~30小时内,CH4的平均生成速率vI、vⅡ和vⅢ从小到大的顺序为________;反应开始后的12小时内,在第____种催化剂的作用下,收集的CH4最多。
②将所得的CH4与H2O(g)通入聚焦太阳能反应器,发生CH4(g)+H2O(g)![]() CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=________。
④下列现象能说明该反应已经达到平衡状态的是________(填编号)。
A.容器内CH4、H2O、CO、H2单位物质的量之比为1:1:1:3
B.容器内气体的密度恒定
C.容器内气体的压强恒定
D.3v( CO)=v(H2)
(2)LiBH4为近年来常用的储氢材料。
①反应2LiBH4 =2LiH+2B +3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____ mol。
②图3是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s) +2B(s) =MgB2(s) △H=____。
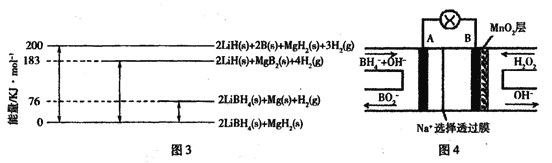
(3)图4是直接硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH___(填“增大”、“减小”或“不变”),负极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述下列反应的现象并写出反应的离子方程式。
(1)向FeCl3溶液中滴加NaOH溶液,现象:__________________,离子方程式:____________________。
(2)向NaHCO3溶液中滴加稀H2SO4,现象:__________________,离子方程式:____________________。
(3)稀HNO3和Ba(OH)2溶液混合,现象:__________________,离子方程式:______________________。
(4)比较:上述三个离子反应发生的条件的不同点是__________________;相同点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B. 在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C. 自发进行的反应一定能迅速进行
D. 一个反应能否自发进行,与焓变和熵变的共同影响有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水的电离的说法正确的是
A. 将水加热,KW增大,pH不变
B. 向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大
C. 向水中加入少量NaOH固体,恢复到原温度,水的电离被抑制,c(OH—)增大
D. 向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用系统命名法命名的有机物名称正确的是( )
A. 2 -甲基--4--乙基戊烷 B. 2, 3 --二甲基--1--戊烯
C. 3, 4, 4--三甲基己烷 D. 2, 2--二甲基-2-丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com