
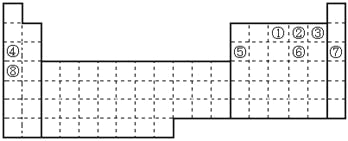
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:
(1)画出⑥的离子结构示意图__________。
(2)在②、③、④、⑤四种元素中,其简单离子半径按由大到小的排列顺序为______(示例:用r(A2-)>r(B-)的形式表示)。
(3)元素②、③氢化物的稳定性由强到弱的顺序为________(填化学式)。
(4)与③同一主族并且在短周期的元素的某种含氧酸可以消毒杀菌,写出该物质的电子式___________________________。
(5)表中能形成两性氢氧化物的元素是_______(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式____________________________。
(6)比较①与其同族短周期元素的氢化物的熔沸点高低,并说明理由_____________。
【答案】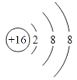 r(O2-)>r(F-)>r(Na+)>r(Al3+)HF>H2O
r(O2-)>r(F-)>r(Na+)>r(Al3+)HF>H2O![]() Al2Al+2OH–+2H2O=2AlO2–+3H2↑NH3>PH3;两者都为分子晶体,NH3存在分子间氢键,增强分子间作用力,导致熔沸点比PH3高
Al2Al+2OH–+2H2O=2AlO2–+3H2↑NH3>PH3;两者都为分子晶体,NH3存在分子间氢键,增强分子间作用力,导致熔沸点比PH3高
【解析】
根据元素①~⑧在元素周期表中的位置可知分别是N、O、F、Na、Al、S、Ar、K。则
(1)硫离子的结构示意图为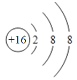 ;
;
(2)②、③、④、⑤四种元素中,其简单离子具有相同的核外电子排布,离子半径随原子序数的增大而减小,则离子半径按由大到小的排列顺序为r(O2-)>r(F-)>r(Na+)>r(Al3+);
(3)同周期自左向右非金属性逐渐增强,氢化物稳定性逐渐增强,因此元素②、③氢化物的稳定性由强到弱的顺序为HF>H2O;
(4)与③同一主族并且在短周期的元素的某种含氧酸可以消毒杀菌,该元素是Cl,含氧酸是次氯酸,其电子式为![]() ;
;
(5)氢氧化铝是两性氢氧化物,则表中能形成两性氢氧化物的元素是Al,该元素的单质与⑧的最高价氧化物的水化物氢氧化钾反应的离子方程式为2Al+2OH–+2H2O=2AlO2–+3H2↑;
(6)NH3、PH3都为分子晶体,NH3存在分子间氢键,增强分子间作用力,导致熔沸点比PH3高。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,A与B可形成BA型化合物,且A元素是卤族元素中非金属性最强的元素;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3,自然界中含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性;而其最高价氧化物对应的水化物为强酸;E元素原子的最外层电子数比次外层电子数多4。
(1)写出下列元素的元素符号:A.________,B.______,C.________,D.________,E.________。
(2)写出C1、C2、C3三种原子的符号:C1________,C2________,C3________。
(3)E2-的结构示意图为________。
(4)A与B形成的化合物的化学式是_______,最常见的E原子与C2形成的分子中含________个中子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )。

A. 正极反应式:Ca+2Cl--2e-=CaCl2
B. 放电过程中,Li+向负极移动
C. 每转移0.1 mol电子,理论上生成20.7 g Pb
D. 常温时,在正、负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按纯净物、混合物、电解质、非电解质的顺序排列的是( )
A.纯碱、稀盐酸、氢氧化钠、干冰B.醋酸、盐酸、铜、氨气
C.石灰石、石油、水、硫酸钡D.烧碱、海水、氯化钠、氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,已知Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝。

实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是________________。
(2)写出C中反应的化学方程式:_______________________________________。
(3)D的作用是___________________________________________________,
反应的离子方程式为_______________________________________________。
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是________________________,
反应的离子方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1. 77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________,溶液中![]() ___________。
___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A. v (A)=12 mol / (L·min) B. v (D)=0.4 mol / (L·s)
C. v (C)=30 mol / (L·min) D. v (B)=0.6 mol / (L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲乙两池均为1 mol·L–1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+ 浓度越大,氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液中Ag+浓度增大
C. 断开K1,闭合K2后,NO3–向A电极移动
D. 断开K1,闭合K2后,B电极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com