
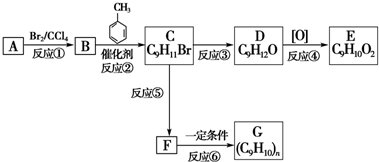
 ;
; ;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为
;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为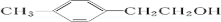 ,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为
,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为 ;
;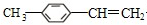 ,G为
,G为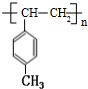 ,据此进行解答.
,据此进行解答. ;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为
;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为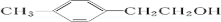 ,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为
,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为 ;
; ,G为
,G为 ,
,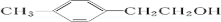 ,
,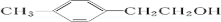 ;
; 和HBr,该反应为取代反应;
和HBr,该反应为取代反应; ,则反应条件为:NaOH醇溶液、加热,
,则反应条件为:NaOH醇溶液、加热, 发生加聚反应生成
发生加聚反应生成 ,反应方程式为:n
,反应方程式为:n
| 一定条件 |
 ,
,
| 一定条件 |
 ;
;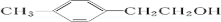 、E为
、E为 ,二者在浓硫酸作用下加热可以发生酯化反应生成
,二者在浓硫酸作用下加热可以发生酯化反应生成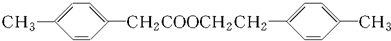 ,反应的化学方程式为:
,反应的化学方程式为: +
+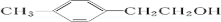
| 浓硫酸 |
| △ |
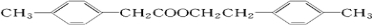 ,
, +
+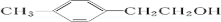
| 浓硫酸 |
| △ |
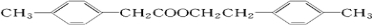 ;
;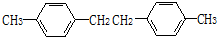 ,
,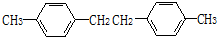 .
.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
B、向苯酚钠溶液中通入CO2: +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
| C、小苏打溶液中加入少量石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| D、NaHS水解反应:HS-+H2O?S2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
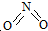 和
和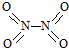 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
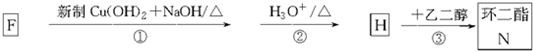
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 标准溶液(H2SO4)(aq) 浓度(mol/L) | 滴定完成时耗酸 体积V(mL) | 待测溶液(NaOH)(aq) 体积V(mL) |
| 1 | 1.000 | 11.00 | 25.00 |
| 2 | 1.000 | 12.04 | 25.00 |
| 3 | 1.000 | 12.18 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
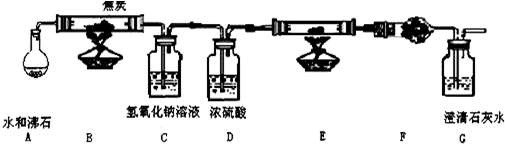
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L液态水分解成2L氢气与1L氧气吸收571.6 kJ热量 |
| B、2 mol氢气与1mol氧气反应生成2mol气态水放出热量大于571.6 kJ |
| C、在相同条件下,2 mol氢气与1mol氧气的能量总和大于2mol液态水的能量 |
| D、使用催化剂能降低该反应的活化能使反应放出得热量小于571.6 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com