
【题目】电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。下图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极。

下列有关描述错误的是
A.阳离子交换膜是A,不是B
B.通电后阳极区的电极反应式:2Cl--2e-→Cl2↑
C.工业上阴极使用铁丝网代替石墨碳棒,以减少石墨的损耗
D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol/L的下列六种溶液的pH如表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子结合H+能力最强的是________。
②根据表中数据,浓度均为0.01 mol/L的下列五种物质的溶液中,酸性最强的是________(填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是________。
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
③下列关于NaHCO3饱和溶液的表述,正确的是________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
④根据上表数据,请你判断下列反应不能成立的是________。
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
⑤要增大氯水中![]() 的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
(2)依据表中数据计算CH3COOH的电离常数Ka=________(已知100.4=2.5,用科学计数法表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
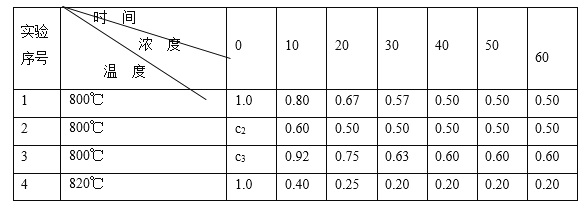
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在史前就为人们所知,由于铁、钴、镍性质很相似故称为铁系元素。回答下列问题:
(1)铁、钴、镍中未成对电子数目最多的为_____,镍的外围电子轨道表达式为_____。
(2)Co2+可以和SCN-作用形成蓝色配离子,该反应可用于Co2+的定性检验。
①SCN-的空间构型为____,组成元素中第一电离能最大的是___。
②SCN-对应的酸有硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中后者沸点较高,主要原因是_________________。
(3)二茂铁是一种夹心式结构的配合物,通常认为是由一个Fe2+离子和两个C5H5-离子形成的,X射线研究结果指出两个C5H5-环的平面是平行的,结构如图1所示。C5H5-中碳原子的杂化类型为_____。分子中的大π键盘可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
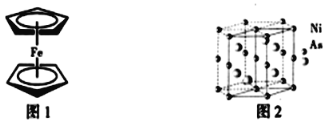
(4)NiAs晶体中的原子堆积方式如图2所示,其中As的配位数为______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,NiAs的密度为______g·cm-3,(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3-
B.氯化钠固体与浓硫酸混合微热:Cl-+H+![]() HCl↑
HCl↑
C.氯气通入石灰乳:Cl2+2OH-=Cl-+ClO-+H2O
D.苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组制备SO2并探究SO2的相关性质,他们设计了如图装置(夹持仪器省略):

(1)实验需要大约100mL的1:1硫酸(浓硫酸与溶剂水的体积比),配制该硫酸时需要的玻璃仪器是:玻璃棒、______、_______,配制过程_______________________________。
(2)图中装置A的作用是________________________________。
(3)若需要对比干燥SO2和湿润的SO2的漂白性,则各仪器中需要加入的试剂分别是:
C:_____________D:_________ E:品红溶液 F:NaOH溶液
若需要先后验证SO2的氧化性与还原性,则各仪器中需要加入的试剂分别是:
C:空瓶 D:_____________ E:_________ F:NaOH溶液
写出验证SO2还原性装置中的离子反应方程式__________________________________。
(4)亚硫酸钠易被氧化,在下列方框内设计一个实验流程图测定亚硫酸钠的质量分数,设样品质量为W克,流程图样例如下,需要测定的数据自行设定符号表示,列出亚硫酸钠质量分数的计算表达式___________________,并说明各符号的意义:________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可直接用于自来水的消毒,也可以制取漂粉精、高铁酸钠等物质来对自来水消毒。
(1)氯气通入水中可用来杀菌消毒,其中杀菌消毒的原理是___,其有效成分的电子式是____。
(2)氯气可用来制取漂粉精,但干燥的氢氧化钙与氯气并不易发生反应,氯气只能被氢氧化钙所吸附。为此,在工业上采用加入少许水的消石灰来进行氯化。其原因是____;
(3)漂粉精的消毒能力受水的pH影响,pH较小时的消毒能力____(填“大于”或“小于”) ;pH大时的消毒能力,其原因是______。
(4)用氯气对饮用水消毒副作用多,产生影响人体健康有机氯衍生物。可用氯气制取高铁酸钠净水:___Fe3++____ (__________) + ___Cl2→___FeO42-+____ +___H2O
补全缺项,并配平上述离子方程式;
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气____倍。说明该净水剂与氯气相比较有何优越性 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,等体积、PH相同的盐酸和醋酸溶液分别加水稀释,溶液中的随溶液体积变化的曲线如图所示。据图判断下列说法正确的是

A.b点酸的总浓度大于a点酸的总浓度
B.b点溶液的导电性比c点溶液的导电性弱
C.取等体积的a点、b点对应的溶液,消耗的NaOH的量相同
D.曲线Ⅰ表示的是盐酸的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业冶炼钛的第一步反应为:TiO2(s)+2C(s)+2Cl2![]() TiCl4(g)+2CO。下列关于该反应的说法正确的是( )
TiCl4(g)+2CO。下列关于该反应的说法正确的是( )
A.TiCl4既是氧化产物又是还原产物
B.氧化剂与还原剂的物质的量之比为1:1
C.当转移电子数目为0.2NA时,气体体积增大1.12L
D.当有26g固体参加反应时,转移电子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com