
【题目】下列离子方程式正确的是
A.氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3-
B.氯化钠固体与浓硫酸混合微热:Cl-+H+![]() HCl↑
HCl↑
C.氯气通入石灰乳:Cl2+2OH-=Cl-+ClO-+H2O
D.苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH-
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O![]() CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3 [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,![]() 减小
减小
d.稀释溶液,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1己二酸(简写为H2A,电离常数分别为Ka1、Ka2)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是

A.Ka1=10-4.4
B.曲线II表示的是HA-的物质的最分数δ(X)肋pH的变化关系
C.NaHA溶液中:c(H+)=c(OH-)+2c(A2-)-c(H2A)
D.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吗氯贝胺是一种治疗抑郁症的药物,其中一种合成路线及相关转化如图所示:
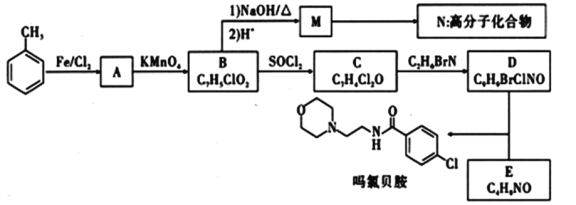
已知信息:①、![]()
②![]() +HCl
+HCl
(1)B的名称_____。
(2)C的结构简式______;A到B的反应类型为______;D中含氧官能团的名称_____。
(3)请写出形成N高分子化合物的方程式________。
(4)写出由D和E反应生成吗氯贝胺的方程式_______。
(5)物质I比C的相对原子质量大14,符合下列条件I的同分异构体有__种。
①能发生银镜反应 ②苯环上有三个取代基
(6)结合以上合成路线信息,设计以CH3-![]() -CH3和CH3-CH2-NH2为原料(无机试剂任选),合成有机物
-CH3和CH3-CH2-NH2为原料(无机试剂任选),合成有机物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。下图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极。

下列有关描述错误的是
A.阳离子交换膜是A,不是B
B.通电后阳极区的电极反应式:2Cl--2e-→Cl2↑
C.工业上阴极使用铁丝网代替石墨碳棒,以减少石墨的损耗
D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶硫酸亚铁部分失水时,分析结果如仍按FeSO4·7H2O的质量分数计算,其值会超过100%。国家标准规定,FeSO4·7H2O的含量:一级品99.50%~100.5%;二级品99.00%~100.5%;三级品98.00%~101.0%。
为测定样品中FeSO4·7H2O的质量分数,可采用在酸性条件下与高锰酸钾溶液进行滴定。
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O;
2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O
测定过程:粗配一定浓度的高锰酸钾溶液1L,然后称取0.200 g 固体Na2C2O4(式量为134.0)放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70℃~80℃。
(1)若要用滴定法测定所配的高锰酸钾溶液浓度,滴定终点的现象是_______________。
(2)将溶液加热的目的是____;反应刚开始时反应速率较小,其后因非温度因素影响而增大,根据影响化学反应速率的条件分析,其原因可能是______________________。
(3)若滴定时发现滴定管尖嘴部分有气泡,滴定结束气泡消失,则测得高锰酸钾浓度_____(填“偏大”“偏小”“无影响”)。
(4)滴定用去高锰酸钾溶液29.50mL,则c(KMnO4)=_____mol/L(保留四位有效数字)。
(5)称取四份FeSO4·7H2O试样,质量均为0.506g,,用上述高锰酸钾溶液滴定达到终点,记录滴定数据
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(高锰酸钾)/mL(初读数) | 0.10 | 0.20 | 0.00 | 0.20 |
V(高锰酸钾)/mL(终读数) | 17.76 | 17.88 | 18.16 | 17.90 |
该试样中FeSO4·7H2O的含量(质量分数)为_________(小数点后保留两位),符合国家______级标准。
(6)如实际准确值为99.80%,实验绝对误差=____%,如操作中并无试剂、读数与终点判断的失误,则引起误差的可能原因是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
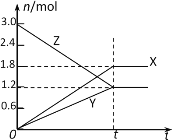
A.该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸。在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:
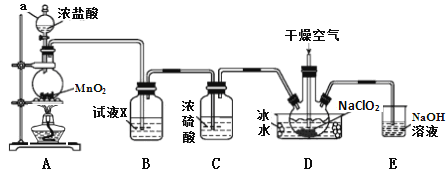
(1)仪器a的名称为_____________,装置A中反应的离子方程式为_______________。
(2)试剂X是_______________________。
(3)装置D中冰水的主要作用是___________。装置D内发生反应的化学方程式为_______________。
(4)装置E中主要反应的离子方程式为:____________________________。
(5)已知NaClO2饱和溶液在不同温度时析出的晶体情况如下表。
温度 | <38℃ | 38℃~60℃ | >60℃ |
析出晶体 | NaClO2·3H2O | NaClO2 | 分解成NaClO3和NaCl |
利用NaClO2溶液制得NaClO2晶体的操作步骤: 55℃蒸发结晶、_________、38~60℃的温水洗涤、低于60℃干燥。
(6)工业上也常用以下方法制备ClO2。
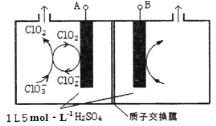
①酸性条件下双氧水与NaClO3反应,则反应的离子方程式为_______________________。
②如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。则阴极电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com