
����Ŀ��Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeSO4��Һ��Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=1������Fe2+��Fe3+��ˮ�⣩��FeSO4��Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����28.0g������ȡͬ����FeSO4��Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0g��
��1��д����Ӧ���漰�Ļ�ѧ����ʽ������3����__��__��__
��2��ͨ�����㣬��д�±���
c��H+�� | c��SO42���� | c��Fe2+��Fe3+�� |
__ | __ | __ |
ע��c��Fe2+��Fe3+����ʾFe2+��Fe3+���ܵ����ʵ�����Ũ��
��3������ԭ��Һ��Fe2+�������İٷ���__��
���𰸡�BaCl2+FeSO4=BaSO4��+FeCl2 FeCl2+2NaOH=Fe��OH��2��+2NaCl 2Fe��OH��3![]() Fe2O3+3H2O 0.1mol/L 0.6mol/L 0.5mol/L 20%
Fe2O3+3H2O 0.1mol/L 0.6mol/L 0.5mol/L 20%
��������
(1)������Ϣд����Ӧ����ʽ��
(2)����pH��1��֪����Һ��������Ũ����0.1mol/L��28.0g���������ᱵ�����ʵ�����0.12mol��Ũ����![]() =0.6mol/L��8.0g�����������������ʵ�����0.05mol��������ԭ�ӵ����ʵ�����0.1mol�����Fe2+��Fe3+���ܵ����ʵ�����Ũ����
=0.6mol/L��8.0g�����������������ʵ�����0.05mol��������ԭ�ӵ����ʵ�����0.1mol�����Fe2+��Fe3+���ܵ����ʵ�����Ũ����![]() ��0.5mol/L��
��0.5mol/L��
(3)���ݵ���غ���м��㡣
(1)FeSO4��Һ200mL�����������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����27.96gΪ���ᱵ��������Ӧ��ѧ����ʽΪ��BaCl2+FeSO4=BaSO4��+FeCl2������ȡͬ����FeSO4��Һ200mL�������м��������NaOH��Һ������ʹ���ַ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��FeCl2+2NaOH=Fe(OH)2��+2NaCl��������ȫ����Ϊ���ɫ��ӦΪ��4Fe(OH)2+O2+2H2O=4Fe(OH)3�����ˡ�ϴ�Ӳ��������ù��壬���յõ����������Ϊ8.00gΪFe2O3����Ӧ�Ļ�ѧ����ʽΪ��BaCl2+FeSO4=BaSO4��+FeCl2�� FeCl2+2NaOH=Fe(OH)2��+2NaCl��2Fe(OH)3![]() Fe2O3+3H2O��
Fe2O3+3H2O��
(2)��pH=1��c(H+)=0.1molL-1
��SO42-+Ba2+=BaSO4����c(SO42-)=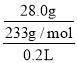 =0.6molL-1��
=0.6molL-1��
��Ϊ���չ�������ΪFe2O3��
����n(Fe2O3)=![]() =0.05mol
=0.05mol
����Ԫ���غ�ã�
c(Fe2+��Fe3+)=![]() =0.5mol/L��
=0.5mol/L��
(3)����غ㣺2c(Fe2+)+3c(Fe3+)+c(H+)=2c(SO42-)��
2c(Fe2+)+3c(Fe3+)=1.1mol/L��
c(Fe2+)��c(Fe3+)=0.5mol/L
c(Fe2+)=0.4mol/L
c(Fe3+)=0.1mol/L
FeSO4��Һ��Fe2+�������İٷ��ʣ�![]() =20%��
=20%��
��ԭ��Һ��Fe2+�������İٷ���Ϊ20%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ���������ڱ��е�λ�ã��û�ѧ����ش��������⣺
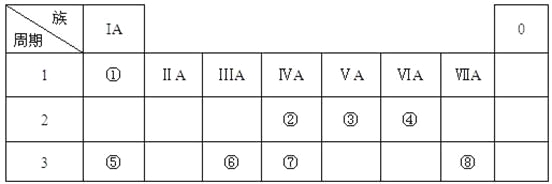
��1��������������ԭ�Ӱ뾶�ɴ�С��˳��Ϊ______________��
��2����������������ۺ������������ǿ������˳����__________��
��3��������̬�⻯��ĵ���ʽ_____��
��4����������������Ӧˮ�������Һ�뵥�������������ֱ�Ӧ�����ӷ���ʽ___��____��
��5���������ڵ�������ȼ�գ�����Ϊ__________ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ����ǿ�������Դ�����п�����Ӧ�õĹ���ǰ����
��1����֪��CH3OH(g)=HCHO(g)+H2(g) ��H=+84kJmol1��2H2(g)+O2(g)�T2H2O(g)��H=484kJmol1����ҵ�ϳ��Լ״�Ϊԭ����ȡ��ȩ����д��CH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)���Ȼ�ѧ����ʽ______________��
��2����ҵ���ں����ܱ������пɲ������з�Ӧ�ϳɼ״�CO(g)+2H2(g)![]() CH3OH(g)��H
CH3OH(g)��H
�����жϸ÷�Ӧ�ﵽƽ��״̬��������_________(��ĸ���)��
A��2 ����(H2) = �� ��(CO)
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1:2:1
F��CO��H2��CH3OH������֮��Ϊ1:2:1
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ���÷�Ӧ��H_______0���������������

��һ���¶���,��4a mol H2��2a mol CO����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ50������÷�Ӧ��ƽ�ⳣ��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���ڵ�����Ģ�pH=0��H2SO4��Һ����0.05 mol/L��Ba(OH)2��Һ��pH=10��Na2S��Һ����pH=5��NH4NO3��Һ�У����������ˮ�����ʵ���֮����
A.![]() B.
B.![]()
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס���������ϡ��Һ����pH=a���ҵ�pH=a+1�������ж���ȷ����( )
A.������ˮ���������H+�����ʵ���Ũ�����ҵ�![]()
B.�ס�������Һ���ʵ���Ũ��֮��Ĺ�ϵ��c(��)=10c(��)
C.�üס��ҷֱ��кͺ��е����ʵ�����NaOH��Һ�� ���ߵ����(V)֮��Ĺ�ϵΪ10V(��)>V(��)
D.���е�c(OH-)Ϊ���е�c(OH-)��10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ĿҪ��ش��������⡣
(1)�����£�Ũ�Ⱦ�Ϊ0.1 mol/L������������Һ��pH�����ʾ��
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
����������Һ�е������ӽ��H+������ǿ����________��
�ڸ��ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01 mol/L�������������ʵ���Һ�У�������ǿ����________(����ĸ��ţ���ͬ)��������Һ�ֱ�ϡ��100����pH�仯��С����________��
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
�����й���NaHCO3������Һ�ı�������ȷ����________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-�ĵ���̶ȴ���HCO3-��ˮ��̶�
�ܸ����ϱ����ݣ������ж����з�Ӧ���ܳ�������________��
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
��Ҫ������ˮ��![]() ��Ũ�ȣ�������ˮ�м���������̼��������Һ��д��Cl2��HCO3-��Ӧ�����ӷ���ʽΪ________��
��Ũ�ȣ�������ˮ�м���������̼��������Һ��д��Cl2��HCO3-��Ӧ�����ӷ���ʽΪ________��
(2)���ݱ������ݼ���CH3COOH�ĵ��볣��Ka=________(��֪100.4=2.5���ÿ�ѧ��������ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��Ӧ2C(s)��O2(g)![]() 2CO(g)��2CO(g)��O2(g)
2CO(g)��2CO(g)��O2(g)![]() 2CO2(g)���Ƿ��ȷ�Ӧ���ݴ��ƶ�����ͬ�����£�����˵������ȷ����(����)
2CO2(g)���Ƿ��ȷ�Ӧ���ݴ��ƶ�����ͬ�����£�����˵������ȷ����(����)
A.56 g CO��32 g O2�����е�������֮�ʹ���88 g CO2�����е�������
B.12 g C�����е�����һ������28 g CO�����е�����
C.12 g C��32 g O2���������������44 g CO2�����������
D.������������ȵ�̼��ȫȼ�գ�����CO2�ķ�Ӧ������CO�ķ�Ӧ�ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��FΪ������Ԫ�أ��ǽ���Ԫ��A����������������������ͬ��B����������������������������2����B��D�ĵ����г��ȼ������������ۻ�����BD2��E+��D2-������ͬ�ĵ�������A��F�ǵ�����ȼ�գ���������ˮ�õ�һ��ǿ�ᡣ�����й�˵����ȷ���ǣ�������
A.��ҵ��F������MnO2��AF���Ʊ�
B.BԪ�����γɵĵ��ʵľ������Ͷ�����ͬ��
C.F���γɵ��⻯�������ǿ��BD2��ˮ��������ԣ�˵��F�ķǽ�����ǿ��B
D.�ɻ�ѧ���Ƕ��ƶϣ����γ�BDF2���ֻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.�Ȼ�����Һ��һ������̼������Һ��Ӧ��Al3++3CO32��+3H2O=Al(OH)3��+3HCO3��
B.�Ȼ��ƹ�����Ũ�������ȣ�Cl��+H+![]() HCl��
HCl��
C.����ͨ��ʯ���飺Cl2+2OH��=Cl��+ClO��+H2O
D.��������Һ�ʼ��Ե�ԭ����C6H5O��+H2O��C6H5OH+OH��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com