
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
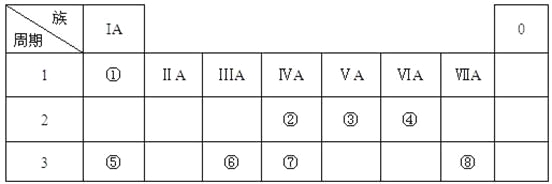
(1)④、⑤、⑥的原子半径由大到小的顺序为______________。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是__________。
(3)③的气态氢化物的电子式_____。
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式___、____。
(5)单质①在单质⑧中燃烧,火焰为__________色。
【答案】Na>Al>O HClO4>H2CO3>H2SiO3 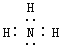 2Al+2OH-+2H2O=2AlO2-+3H2↑ Cl2+2OH-= Cl-+ ClO-+ H2O 苍白
2Al+2OH-+2H2O=2AlO2-+3H2↑ Cl2+2OH-= Cl-+ ClO-+ H2O 苍白
【解析】
由周期表相对位置可知,①为H元素、②为C元素、③为N元素、④为O元素、⑤为Na元素、⑥为Al元素、⑦为Si元素、⑧为Cl元素。
(1)根据元素周期表和元素周期律可知,原子半径随电子层数的增多而增大,随核电荷数的增多而减小,则④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O,故答案为:Na>Al>O;
(2)同周期元素,原子序数越大,非金属性越强;同种族元素,原子序数愈小,非金属性越强,则②、⑧、⑦三种元素的非金属性Cl>C>Si,最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3,故答案为:HClO4>H2CO3>H2SiO3;
(3)③的气态氢化物是氨气,氨气是共价化合物,空间构型为三角锥形,电子式是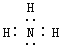 ,故答案为:
,故答案为: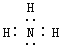 ;
;
(4)⑤为Na元素,最高价氧化物对应水化物为NaOH,单质⑥、单质⑧分别是Al、Cl2,均与氢氧化钠溶液反应,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,Cl2+2OH-= Cl-+ ClO-+ H2O,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Cl2+2OH-= Cl-+ ClO-+ H2O;
(5)氢气在氯气中燃烧的火焰为苍白色,故答案为:苍白。


科目:高中化学 来源: 题型:
【题目】电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是_________(用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是_____________(用元素符号表示);
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态______________;
(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;
(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
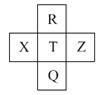
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下有可逆反应:A(g)+2B(g)![]() 2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
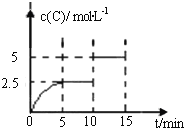
A.在0~5min内,正反应速率逐渐增大
B.反应从起始至5min时,B的转化率为50%
C.5min时的平衡常数与10min时的平衡常数不等
D.第15min时,B的体积分数为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为(C7H5NO)。
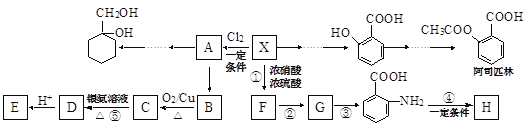
已知:![]() (苯胺,易被氧化)
(苯胺,易被氧化)
完成下列填空:
(1)X的结构简式是______,反应⑤的类型是_________。
(2)反应②③两步能否互换_______(填“能”或“不能”),理由是______。
(3)反应④的化学方程式是____________。
(4)检验B是否完全转化为C的方法是______(选填编号)。
a.定量测熔点 b.定性酸性高锰酸钾溶液
c.定量银氨溶液 d.定性新制氢氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:4NO+4NH3+O2![]() 4N2+6H2O;6NO2+8NH3
4N2+6H2O;6NO2+8NH3![]() 7N2+12H2O。
7N2+12H2O。
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化合物的平均相对分子质量为___。
(2)尾气中NO的含量为___mg/m3。
(3)要处理5m3的尾气,需要氨氧混合气的体积为___L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。
(4)NaOH溶液的物质的量浓度为___mol/L,体积为___mL。
(5)已知反应后溶液中含有0.35molNaNO2。若将尾气中NO与NO2的平均组成记为NOx,通过计算求x___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量。
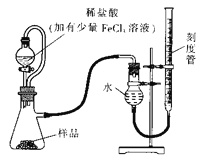
【1】实验前需进行的操作是: _______,稀盐酸中加入少量FeCl3溶液的作用是:_________。
【2】用恒压分液漏斗的优点有:
① ___________;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先_______,再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
【3】推算该样品中过氧化镁的质量分数_______ (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
【4】该实验在滴定前需加入少量______作指示剂;判断到达滴定终点的现象是_____;推算该样品中过氧化镁的质量分数为____(保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com