
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量。
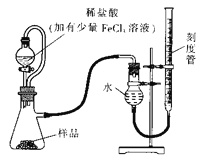
【1】实验前需进行的操作是: _______,稀盐酸中加入少量FeCl3溶液的作用是:_________。
【2】用恒压分液漏斗的优点有:
① ___________;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先_______,再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
【3】推算该样品中过氧化镁的质量分数_______ (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
【4】该实验在滴定前需加入少量______作指示剂;判断到达滴定终点的现象是_____;推算该样品中过氧化镁的质量分数为____(保留三位小数)。
【答案】
【1】 检查装置的气密性 用作催化剂(或催化H2O2的分解)
【2】 消除滴入溶液的体积对所测气体体积的影响 将右侧刻度管缓缓向下移动直到两侧液面相平
【3】![]()
【4】 淀粉溶液 蓝色变无色且半分钟内不变色 0.798
【解析】
1.实验前,需要检查装置是否有漏气现象,过氧化镁与稀盐酸反应生成双氧水,双氧水发生分解需要催化剂。
2.用恒压分液漏斗的优点有:
①确保气体的体积不受影响;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先消除压力差,再平视刻度线读数。
3.a g为MgO2和MgO的质量,b g为MgO的质量,可列方程或利用差量法求出样品中MgO2的质量,从而推算该样品中过氧化镁的质量分数。
4.该实验在滴定前需加入少量淀粉作指示剂;滴定终点时发生颜色改变;推算该样品中过氧化镁的质量分数时,可利用反应建立关系式MgO2——H2O2——I2——2Na2S2O3,然后代入数据进行计算。
【1】为防装置内气体外逸,实验前需进行的操作是:检查装置的气密性,稀盐酸中加入少量FeCl3溶液的作用是:用作催化剂(或催化H2O2的分解)。答案为:检查装置的气密性;用作催化剂(或催化H2O2的分解);
【2】恒压分液漏斗与一般分液漏斗相比,多了一根连通管,可让装置内气体进入漏斗内,避免负压的形成,其优点有:
①消除滴入溶液的体积对所测气体体积的影响;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,为防止产生压力差,影响气体体积的测量,应先将右侧刻度管缓缓向下移动直到两侧液面相平,再平视刻度线读数。答案为:消除滴入溶液的体积对所测气体体积的影响;将右侧刻度管缓缓向下移动直到两侧液面相平;
【3】a g为MgO2和MgO的质量,b g为MgO的质量,n(MgO2)=![]() mol,从而推算该样品中过氧化镁的质量分数为
mol,从而推算该样品中过氧化镁的质量分数为 =
=![]() 。答案为:
。答案为:![]() ;
;
【4】该实验在滴定前需加入少量淀粉溶液作指示剂;判断到达滴定终点的现象是蓝色变无色且半分钟内不变色;在滴定过程中,发生反应的关系式为:
MgO2——H2O2——I2——2Na2S2O3,n(MgO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1 mol/L×28.5 ×10-3L=1.425×10-3mol,该样品中过氧化镁的质量分数为
×0.1 mol/L×28.5 ×10-3L=1.425×10-3mol,该样品中过氧化镁的质量分数为![]() =0.798。答案:淀粉溶液;蓝色变无色且半分钟内不变色;0.798。
=0.798。答案:淀粉溶液;蓝色变无色且半分钟内不变色;0.798。
在确定指示剂的颜色变化时,我们常会把现象弄反,可先确定滴定前的颜色。碘水中滴加淀粉,变蓝色,由此可确定颜色变化为蓝变无。


科目:高中化学 来源: 题型:
【题目】某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:
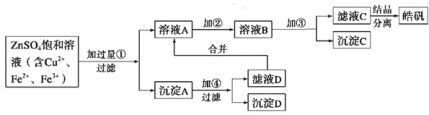
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)3:2.7~3.7;Fe(OH)2:7.6~9.6;Zn(OH)2:5.7~8.0。
试回答下列问题:
(1)加入的试剂①应是________,其目的是____________________________________。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,应选用________,其理由是_____________________。
(3)加入的试剂③是________,目的是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
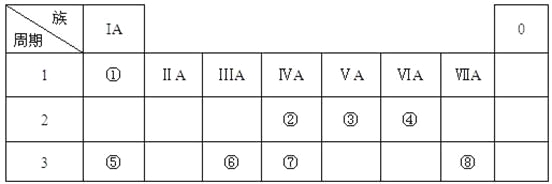
(1)④、⑤、⑥的原子半径由大到小的顺序为______________。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是__________。
(3)③的气态氢化物的电子式_____。
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式___、____。
(5)单质①在单质⑧中燃烧,火焰为__________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
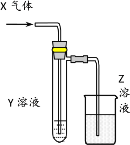
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶内有少量水;④酸式滴定管用蒸馏水洗后,未用标准液润洗;⑤读取滴定管终点读数时,仰视刻度线。
A.①②③B.③④⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJmol1,2H2(g)+O2(g)═2H2O(g)△H=484kJmol1,工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式______________。
(2)工业上在恒容密闭容器中可采用下列反应合成甲醇CO(g)+2H2(g)![]() CH3OH(g)ΔH
CH3OH(g)ΔH
①能判断该反应达到平衡状态的依据是_________(填母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F.CO、H2、CH3OH的速率之比为1:2:1
②CO在不同温度下的平衡转化率与压强的关系如图,该反应△H_______0(填“>”或“<”)。

③一定温度下,将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol/L的Ba(OH)2溶液③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍,B在D的单质中充分燃烧能生成其最高价化合物BD2,E+与D2-具有相同的电子数。A在F是单质中燃烧,产物溶于水得到一种强酸。下列有关说法正确的是( )
A.工业上F单质用MnO2和AF来制备
B.B元素所形成的单质的晶体类型都是相同的
C.F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B
D.由化学键角度推断,能形成BDF2这种化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com