
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
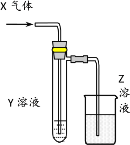
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
Ⅰ直接脱硝
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为___mol/(Lmin)。

Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为___。
Ⅲ氨气脱硝
(3)实验室制取纯净的氨气,除了氯化铵外,还需要___、___(填写试剂名称)。不使用碳酸铵的原因是___(用化学方程式表示)。
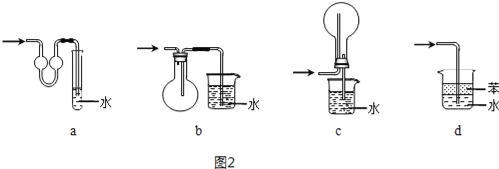
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是___。
NH3脱除烟气中NO的原理如图3:
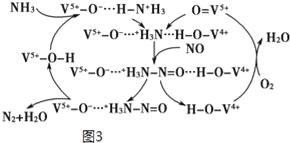
(5)该脱硝原理中,NO最终转化为___(填化学式)和H2O。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:4NO+4NH3+O2![]() 4N2+6H2O;6NO2+8NH3
4N2+6H2O;6NO2+8NH3![]() 7N2+12H2O。
7N2+12H2O。
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化合物的平均相对分子质量为___。
(2)尾气中NO的含量为___mg/m3。
(3)要处理5m3的尾气,需要氨氧混合气的体积为___L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。
(4)NaOH溶液的物质的量浓度为___mol/L,体积为___mL。
(5)已知反应后溶液中含有0.35molNaNO2。若将尾气中NO与NO2的平均组成记为NOx,通过计算求x___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.25℃时,pH=13的1.0LBa(OH) 2溶液中含有的OH-的数目为0.1NA
B.2 gH218O中含有的质子数为NA
C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl—、ClO—和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量。
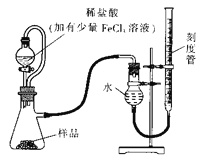
【1】实验前需进行的操作是: _______,稀盐酸中加入少量FeCl3溶液的作用是:_________。
【2】用恒压分液漏斗的优点有:
① ___________;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先_______,再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
【3】推算该样品中过氧化镁的质量分数_______ (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
【4】该实验在滴定前需加入少量______作指示剂;判断到达滴定终点的现象是_____;推算该样品中过氧化镁的质量分数为____(保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的FeO、Fe、Fe3O4的混合物中加入100mL 2 mol/L盐酸,恰好使混合物完全溶解,放出224mL(标准状况)气体,向所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,得到铁的质量是( )
A.5.6 B.4.2 C.2.8 D.1.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
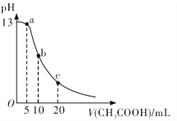
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
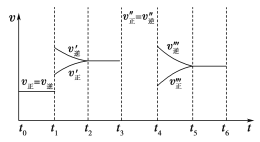
(1)下列时刻所改变的外界条件是:
t1________;t3________;t4________;
(2)物质A的体积分数最大的时间段是________________;
(3)上述图像中C的体积分数相等的时间段是________________;
(4)反应速率最大的时间段是________________。
(5)t0~t1、t3~t4、t5~t6时间段的平衡常数K0、K3、K5的关系________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com