
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.25℃时,pH=13的1.0LBa(OH) 2溶液中含有的OH-的数目为0.1NA
B.2 gH218O中含有的质子数为NA
C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl—、ClO—和HClO的微粒数之和为NA
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)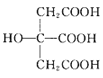 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
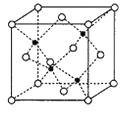
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中。试回答:
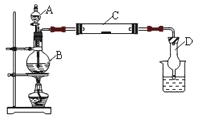
(1)怎样检验装置的气密性_____________________________________;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为_______;写出B中发生反应的离子方程式_________________________________________________。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是__________________。
(4)D的作用是_______________。烧杯中加入的是_____________________。
(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用___________药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用__________________药品替代。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池是日常生活中常用的电池,原料为Zn和MnO2。某工厂用软锰矿(含MnO2约70%及杂质Al2O3)和闪锌矿(含ZnS约80%及少量FeS杂质)共同生产。流程如下:

已知:①A是ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②Ⅳ中反应的方程式为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。
(1)混合物A中,属于还原产物的是______(填化学式)。
(2)加入X的作用是_____________________。已知溶液中各离子开始沉淀的pH如表所示,则加入X后,溶液pH应调整到_____(填字母)。
A.4.5 B.8.0 C.6.5 D.9.0
离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 2.3 | 3.2 |
Al3+ | 4.2 | 5.4 |
Zn2+ | 7.2 | 8.0 |
Mn2+ | 8.3 | 9.8 |
步骤Ⅱ加热的原因是____________________。适宜作为X加入步骤Ⅱ的物质为______(填字母)。
A.MnCO3 B.Zn2(OH)2CO3 C.NaOH D.KOH
(3)生产过程中除矿石外,还有哪些原料需要购买?____________(填化学式)。
(4)若要从步骤Ⅳ的过滤中得到芒硝晶体(Na2SO4·10H2O),则需要进行的实验操作有________、________、过滤、洗涤、干燥等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
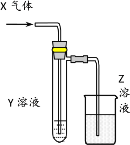
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。

请回答下列问题:
(1)上述流程脱硫实现了______________(选填下列字母编号);
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是___________________;
(3)已知: 25℃、101kpa时,
①Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
②S(s)+O2(g)=SO2(g) △H=-297kJ/mol
③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是_________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________。
(6)KMnO4溶液与MnSO4溶液反应的离子反应方程式是________。
(7)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2_________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家药监局曾发布通告暂停使用和销售含苯丙醇胺的药品制剂,苯丙醇胺(英文缩写为PPA)的结构简式为ΦCHOHCHNH2CH3(其中Φ—代表苯基)。苯丙醇胺是一种一取代苯,取代基是—CHOHCHNH2CH3,请根据信息回答下列问题:
(1)PPA的分子式是________。
(2)它的取代基中有两个官能团,名称是________基和________基。(请填写汉字)
(3)将Φ—、H2N—、HO—在碳链上的位置作变换,可以写出多种同分异构体,其中有5种的结构简式是ΦCHOHCHNH2CH3、ΦCHOHCH2CH2NH2、ΦCH2CHOHCH2NH2、ΦCHNH2CHOHCH3、ΦCHNH2CH2CH2OH,除此5种外,还有______种同分异构体,请写出这几种同分异构体所有的结构简式(不要求写出—OH和—NH2连在同一个碳原子上的异构体,苯基用Φ表示)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5):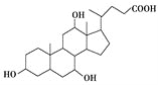
Y:H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
下列叙述错误的是( )
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com